
【题目】正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH![]() (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O
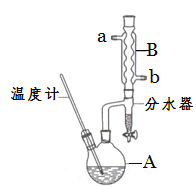
反应物和产物的相关数据如下:
相对分子质量 | 沸点/℃ | 密度/(g·cm—3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成反应:
①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70 mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3 g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11 g。
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为_____________________________。
(2)加热A前,需先从________(填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去_____,振摇后静置,粗产物应在分液漏斗的____口(填“上”或“下”)分离出。
(4)步骤④中最后一次水洗的作用为___________________________________。
(5)步骤⑤中,加热蒸馏时应收集________(填选项字母)左右温度的馏分。
a. 100 ℃ b. 117 ℃ c. 135 ℃ d . 142 ℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满液体时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分是___________,下层液体的主要成分是_________。
(7)本实验中,正丁醚的产率为_________%。(保留2位有效数字)
【答案】先加入正丁醇,再加入浓硫酸 b 浓硫酸 上 洗去有机层中残留的NaOH及中和反应生成的盐 d 正丁醇 水 34
【解析】
(1)步骤①中浓硫酸和正丁醇的添加顺序类似浓硫酸的稀释;
(2)冷凝水的水流方向和气流方向相反;
(3)在反应混合物中,浓硫酸能溶解于水,正丁醚不溶,正丁醇微溶于水,据此分析步骤③的目的;分液漏斗中振荡静置后,上层液体中为密度比水小的正丁醚和正丁醇;
(4)步骤④中粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,氢氧化钠洗涤后,有机层中会残留的NaOH及中和反应生成的盐;
(5)步骤⑤中,加热蒸馏的目的是收集正丁醇;
(6)在135℃下水和正丁醇会转化为气体被蒸出,结合二者密度分析解答;
(7)根据方程式结合实验前提供的37g正丁醇的量计算理论上正丁醚的产量,再计算正丁醚的产率。
(1)步骤①中浓硫酸和正丁醇的添加顺序类似浓硫酸的稀释,应该先加入正丁醇,再加入浓硫酸,故答案为:先加入正丁醇,再加入浓硫酸;
(2)冷凝水的水流方向和气流方向相反,应该下口进,上口出,故答案为:b;
(3)在反应混合物中,浓硫酸能溶解于水,正丁醚不溶,正丁醇微溶于水,所以步骤③的目的是初步洗去浓硫酸;分液漏斗中振荡静置后,上层液体中为密度比水小的正丁醚和正丁醇,从分液漏斗的上口倒出,故答案为:浓硫酸;上;
(4)步骤④中最后一次水洗的目的是为了洗去有机层残留的NaOH及中和反应生成的盐,
故答案为:洗去有机层中残留的NaOH及中和反应生成的盐;
(5)步骤⑤中,加热蒸馏的目的是收集正丁醇,而正丁醇的沸点为142℃,故应收集142℃左右的馏分,故答案为:d;
(6)分水器中收集到液体物质,因正丁醇密度比水小且微溶于水,会分为上下两层,上层为正丁醇,下层主要成分为水,故答案为:正丁醇;水;
(7)实验前提供的37g正丁醇的物质的量为![]() =0.5mol,根据方程式2CH3CH2CH2CH2OH
=0.5mol,根据方程式2CH3CH2CH2CH2OH![]() (CH3CH2CH2CH2)2O+H2O可知,理论上生成正丁醚的物质的量为
(CH3CH2CH2CH2)2O+H2O可知,理论上生成正丁醚的物质的量为![]() =0.25mol,质量为0.25mol×130gmol-1=32.5g,因此正丁醚的产率为
=0.25mol,质量为0.25mol×130gmol-1=32.5g,因此正丁醚的产率为![]() ×100%=34%,故答案为:34%。
×100%=34%,故答案为:34%。


科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理锂电池废料以节约资源、保护环境。锂离子二次电池正极铝钴膜主要含有LiCoO2、A1等,处理该废料的一种工艺如下图所示:

回答下列问题:
(l) Li的原子结构示意图为____,LiCoO2中Co的化合价是____。
(2)“碱浸”时Al溶解的离子方程式为________。
(3)“酸溶”时加入H2O2的目的是____,调节pH后所得滤渣主要为____。
(4)“沉钴”的离子方程式为________。
(5)配制100mL l.0mol/L (NH4)2C2O4溶液,需要的玻璃仪器除玻璃棒、烧杯外,还需要____。
(6)取CoC2O4固体4.41g在空气中加热至300℃,得到钴的氧化物2.41g,则该反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个单环共用一个碳原子的多环化合物称为螺环化合物,共用的碳原子称为螺原子。螺[5,5]十一烷的结构为![]() ,下列关于该化合物的说法错误的是( )
,下列关于该化合物的说法错误的是( )
A.一溴代物有三种
B.与十一碳烯互为同分异构体
C.分子中所有碳原子不可能在同一平面
D.1mo1该化合物完全燃烧需要16mo1O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置如图所示。回答下列问题:
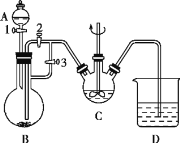
(1)C仪器的名称是___,FeCO3在其中生成,该装置中发生的主要反应的离子方程式为___。
(2)实验时首先打开活塞3,关闭活塞2,再打开活塞1向B中滴加盐酸,其目的是___,关闭活塞1,一段时间后,再关闭活塞___打开活塞__,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中。
Ⅱ.乳酸亚铁晶体((CH3CH(OH)COO)2Fe·3H2O,Mr =288g/mol)是常用的补铁剂。乳酸亚铁可由乳酸与碳酸亚铁反应制得。
(3)将制得的FeCO3加入乳酸溶液中,再加入过量铁粉,75℃下搅拌使之充分反应,结束后,无需过滤,除去过量铁粉的反应方程式为2CH3CH(OH)COOH+Fe=(CH3CH(OH)COO)2Fe+H2↑;从上述所得溶液中获得乳酸亚铁晶体的方法是____、过滤、洗涤、干燥。
(4)该兴趣小组用KMnO4测定产品中亚铁含量进而计算乳酸亚铁晶体的质量分数。发现产品的质量分数总是大于100%,其原因可能是___。
经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol·L-1的Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2标准溶液19.70mL。滴定反应为Ce4++Fe2+=Ce3++Fe3+,则产品中乳酸亚铁晶体的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25 mL 2 mol·L-1Na2CO3和75 mL 1 mol·L-1的稀盐酸:①将Na2CO3溶液缓缓滴到稀盐酸中 ②将稀盐酸缓缓滴到Na2CO3溶液中,在标准状况下产生气体的体积情况( )
A.均为0.84 L
B.均为0.56 L
C.①>②
D.②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是红黄色有毒气体,有刺激性气味,沸点为11℃,极易溶于水但不与水反应,遇热水缓慢水解成次氯酸、氯气和氧气,见光也易分解,因此其溶液置于冷暗处相对稳定。某校合作学习小组的同学欲制备二氧化氯水溶液并检验其性质。
Ⅰ.二氧化氯水溶液制备。
向圆底烧瓶中先加入10gKClO3固体和9gH2C2O4·2H2O(草酸),然后再加入5mL稀硫酸,用磁力搅拌器搅拌(如下图);将烧瓶放在热水浴中,保持水浴温度在60~80℃,至B中广口瓶内溶液呈深红黄色时停止加热。
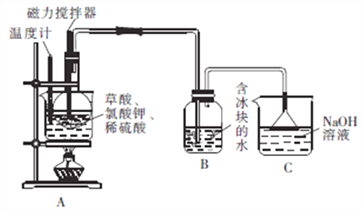
回答下列问题:
(1)装置A用水浴加热的优点是_________________;装置A中水浴温度不宜低于60℃也不宜高于80℃,其原因是______________________。
(2)装置A中反应生成ClO2及KHSO4等产物的化学方程式为_________________。
(3)装置B的水中需放入冰块的目的是_________________,装置C的作用是_______________
Ⅱ.设计实验验证ClO2的氧化性。
(4)取适量ClO2水溶液加入H2S溶液中,振荡,得无色溶液。欲检验H2S的氧化产物,还需要用到的试剂是_______________________。
(5)证明ClO2的氧化性比Fe3+强的方案是______________________。
(6)将少量ClO2水溶液滴入盛有MnSO4溶液的试管中,振荡,有黑色沉淀生成,则该反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4![]() K2MnO4+MnO2+O2↑,将0.1moKMnO4固体加热一段时间后,收集到amolO2;向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中(注:KMnO4和K2MnO4以及MnO2都能与浓盐酸反应并生成Mn2+)。
K2MnO4+MnO2+O2↑,将0.1moKMnO4固体加热一段时间后,收集到amolO2;向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中(注:KMnO4和K2MnO4以及MnO2都能与浓盐酸反应并生成Mn2+)。
(1)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中的还原产物是_____(填化学式),反应中若产生0.3mol的气体则有________mol的电子转移。
(2)a+b的最大值为________,a+b最小值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将 2mol NO2 装入 5 L 带活塞的密闭容器中,当反应 2NO2(g) N2O4(g)ΔH=-60 kJ/mol 达到平衡时,恢复到原来的温度,测得此过程中体系向外界共释放了 40 kJ 的热量。 下列说法正确的是( )
A.温度升高,平衡常数 K 增大
B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C.上述反应达到平衡时,NO2的转化率是 40%
D.若起始时向容器中充入 1.0 mol N2O4,保持温度不变,达到平衡时共吸收 20 kJ的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com