
����Ŀ���ס��ҡ��������ֱ���Al2(SO4)3��FeSO4��NaOH��BaCl2���������е�һ�֣���������Һ��������Һ�У������а�ɫ�������ɣ������μ��������ʧ������Һ�������Һʱ�����������������ݴ˿��ƶϱ�������(����)
A. Al2(SO4)3 B. FeSO4
C. NaOH D. BaCl2
���𰸡�B
����������������Һ��������Һ�У������а�ɫ�������ɣ������μ��������ʧ��ӦΪNaOH��Al2(SO4)3�ķ�Ӧ����Ӧ�ķ���ʽ�У�Al2(SO4)3+6NaOH�T2Al(OH)3��+3Na2SO4��Al(OH)3+NaOH�TNaAlO2+2H2O������Ϊ�����ɰ�ɫ������������ܽ⣬��ΪNaOH����ΪAl2(SO4)3������Һ�������Һ�У���������������ֻ��BaCl2��NaOH����Ӧ�����ΪBaCl2����ˣ���ΪFeSO4����ѡB��
�����͡���ѡ��
��������
14
����Ŀ����ͼ��ʾ��ij��Һ�еμ�Ba(OH)2 ��Һʱ�����������ʵ�����Ba(OH)2 �����ʵ����ı仯��ϵ������Һ�ijɷֿ�����

A. MgSO4 B. Al2 (SO4 )3 C. Fe2 (SO4 )3 D. NaAlO2
���𰸡�B
��������A��������þ����������������Һ���������������ټ�����������Һ�����������䣬A����B����ͼ��֪�ܽ�����������Ҫ1mol������������Al(OH)3��OH��===AlO2����2H2O��֪������Al(OH)3Ϊ2mol����Al2(SO4)3Ϊ1mol������3mol���������������������ᱵ3mol��n��Al3+����n��OH-��=2mol��6mol=1��3��������ӦAl3����3OH��===Al(OH)3�������Եõ�2molAl(OH)3������Ϊ3mol+2mol=5mol��B��ȷ��C��������������������Һ��Ӧ����������������������������������������������������ټ�����������Һ�������������䣬��ͼ��һ�£�C����D��ƫ��������������������Ӧ�����ܲ���������D����ѡB��


 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��2H2(g)+O2 (g)![]() 2H2O(l)�� ��H=��571.6kJmol��1�������й���������ȷ������ ��
2H2O(l)�� ��H=��571.6kJmol��1�������й���������ȷ������ ��
A��2mol H2��ȫȼ������Һ̬ˮʱ�ų�571.6 kJ����
B��1mol H2��ȫȼ������Һ̬ˮʱ�ų�285.8kJ����
C��2���������ȫȼ������Һ̬ˮʱ�ų�571.6 kJ����
D�������Ȼ�ѧ����ʽ�ɱ�ʾΪH2(g)+![]() O2(g) = H2O(l)�� ��H=��285.8 kJmol��1
O2(g) = H2O(l)�� ��H=��285.8 kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������д�����з�Ӧ���Ȼ�ѧ����ʽ��
��1����������N2��O2��ȫ��Ӧ��ÿ����23 g NO2��Ҫ����16.95 kJ���������Ȼ�ѧ����ʽΪ______________________________________________��
��2����NA��ʾ�����ӵ���������C2H2(��̬)��ȫȼ������CO2��Һ̬ˮ�ķ�Ӧ�У�ÿ��5NA������ת��ʱ���ų�650 kJ�����������Ȼ�ѧ����ʽΪ
__________________________________________________________________��
��3����֪��1 mol H��H����1 mol N��H����1 mol N��N���ֱ���Ҫ��������436 kJ��391 kJ��946 kJ����N2��H2��Ӧ����NH3���Ȼ�ѧ����ʽΪ
___________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��1 mol�����еĻ�ѧ����Ҫ����436 kJ��������1 mol�����еĻ�ѧ����Ҫ����498 kJ������������ͼ�е�����ͼ���ش��������⣺

��1���ֱ�д���٢�����ֵ��
��__________����__________��
��2������H2(Xg)�е�1 mol H��O���ų�__________kJ��������
��3����֪��H2O(l)![]() H2O(g)��H��+44 kJ mol1����д����������������ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ��___________________________________��
H2O(g)��H��+44 kJ mol1����д����������������ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ��___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ʵ�����о�Na2CO3��NaHCO3�����ʼ��ת����
��1���ֱ���Ũ�Ⱦ�Ϊ0.1mol/LNa2CO3��NaHCO3��Һ�еμӼ��η�̪�Լ���
��Na2CO3��Һ����ɫ��Ϊ��ɫ����ԭ���� ��
��NaHCO3��ҺҲ����ɫ��Ϊ��ɫ����ԭ���� ��
�۱Ƚ�������Һ����ɫ����ɫ��dz�������ѧʽ����
��2���о�NaHCO3��CaCl2�ķ�Ӧ��
ʵ����� | ʵ����� | ʵ������ |
ʵ��1 | ��2mL 0.001mol/L NaHCO3��Һ�м���1mL 0.1mol/LCaCl2��Һ | �����Ա仯���ü�������䣬û�г��ֹ�����ͨ·�� |
ʵ��2 | ��2mL 0.1mol/L NaHCO3��Һ�м���1mL 0.1mol/LCaCl2��Һ | ����ɫ���ȵĻ��ǣ��ü�������䣬���ֹ�����ͨ·�� |
��ʵ��1��û�г��ְ�ɫ���ǵ�ԭ���� ��
��ʵ��2���γɵķ�ɢϵ���� ��
�������ӷ���ʽ��ʾʵ��2�з����ķ�Ӧ ��
��3���ڲ������������ʵ�ǰ���£�ʵ��Na2CO3��NaHCO3֮���ת��������ͼ�б�����õ��Լ������������ʵ�Ũ�ȣ���Ӧǰ����Һ����ı仯�ɺ��ԣ��� 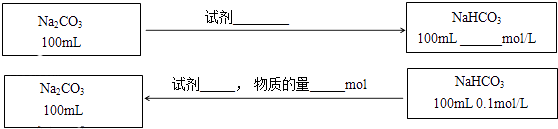
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʢ���Ҵ����ձ���Ͷ��һС������ƣ����Թ۲쵽��������(����)
A. �ƿ鸡���Ҵ�Һ����
B. �ƿ��۳�С��
C. �ƿ����Ҵ���Ӧ������˻˻��������
D. �ƿ���������ݲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���½�35 mL��̬������ȫȼ�գ��ָ���ԭ��״���£��õ�������̼����140 mL��������ķ���ʽΪ
A. C5H12B. C4H10C. C3H6D. C3H8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ��CaCO3��ˮ�е��ܽ�ƽ��������ͼ��ʾ����֪��25�����ܶȻ�Ϊ2.8��10��9 mol2/L2 �� ����˵������ȷ���ǣ� �� 
A.x��ֵΪ2��10��5
B.c��ʱ��̼��Ƴ�������
C.��������ˮ��ʹ��Һ��d��䵽a��
D.b����d���Ӧ���ܶȻ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�����Ʒ����������Na2SO4��Na2CO3�����������̽��о�����
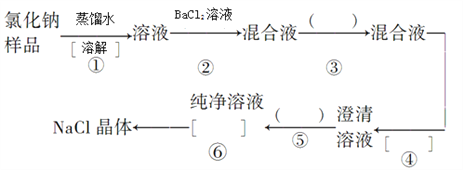
��1������ۼ����������________������ݼ�����������������________�������������__________��
��2��д���йط�Ӧ���ӷ���ʽ
�����________________��__________________��
�����________________________________��
��3���ڽ��Т١��ܡ�����ʱ����Ҫ�õ��������������÷ֱ��ǣ������_________________�� ��________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com