
| A. | 25℃时加入等体积等浓度的NaOH溶液后溶液的pH一定大于7 | |
| B. | c(C2O42- )<c( OH-) | |
| C. | c(Na+)+c(H+)>c(C2O42- )+c( HC2O4-)+c( OH-) | |
| D. | c(Na+)>c( HC2O4-)>c(H2C2O4)>c(C2O42- ) |
分析 已知:25℃时0.lmol•L-lNaHC2O4溶液的pH=5.5,溶液显酸性说明HC2O4-电离程度大于其水解程度,
A.25℃时加入等体积等浓度的NaOH溶液后恰好完全反应生成草酸钠,草酸根离子水解溶液显碱性;
B.溶液显酸性说明HC2O4-电离程度大于其水解程度;
C.溶液中存在电荷守恒分析判断;
D.溶液显酸性说明HC2O4-电离大于其水解程度,据此分析离子浓度大小.
解答 解:A.25℃时加入等体积等浓度的NaOH溶液后恰好完全反应生成草酸钠,草酸根离子水解溶液显碱性,25℃时加入等体积等浓度的NaOH溶液后溶液的pH一定大于7,故A正确;
B.溶液显酸性说明HC2O4-电离程度大于其水解程度,c(C2O42- )>c( OH-),故B错误;
C.溶液中存在电荷守恒,c(Na+)+c(H+)=2c(C2O42- )+c( HC2O4-)+c( OH-),故C错误;
D.溶液显酸性说明HC2O4-电离大于其水解程度,溶液中离子浓度大小,c(Na+)>c( HC2O4-)>c(C2O42- )>c(H2C2O4),故D错误;
故选A.
点评 本题考查盐类水解、弱电解质电离平衡的影响因素、电解质溶液中电荷守恒判断以及离子浓度大小比较知识,注意盐的水解原理的应用是重点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在过渡元素中寻找优良的催化剂 | |
| B. | 由元素周期律HC1O4可以类推出氟元素也存在最高价氧化物的水化物HFO4 | |
| C. | 在元素周期表的金属和非金属分界线附近寻找半导体材料 | |
| D. | 在化工生产中应遵循“绿色化学”的思想 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的蛋白质均可通过颜色反应来鉴别 | |
| B. | 淀粉和纤维素表达式为(C6H10O5)n,互为同分异构体 | |
| C. | 糖类、油脂、蛋白质均有C、H、O三种元素组成 | |
| D. | 油脂在碱性条件下水解生成甘油和高级脂肪酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
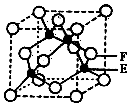 A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大.A的原子半径在周期表中最小,B原子核外电子有6种不同的运动状态.C元素原子的最外层电子数是次外层电子数的3倍.D元素第一电离能至第四电离能分别是I1=578kJ/mol、I2=1817kJ/mol、I3=2745kJ/mol、I4=11575kJ/mol.E与B可形成正四面体形分子.F的一种同位素的质量数为63,中子数为34.回答下列问题:
A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大.A的原子半径在周期表中最小,B原子核外电子有6种不同的运动状态.C元素原子的最外层电子数是次外层电子数的3倍.D元素第一电离能至第四电离能分别是I1=578kJ/mol、I2=1817kJ/mol、I3=2745kJ/mol、I4=11575kJ/mol.E与B可形成正四面体形分子.F的一种同位素的质量数为63,中子数为34.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷制一氯甲烷、苯制溴苯 | |
| B. | 乙醇制乙醛、乙醇和乙酸制乙酸乙酯 | |
| C. | 乙醇制乙烯、乙烯制乙醇 | |
| D. | 苯制环己烷、乙酸乙酯水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
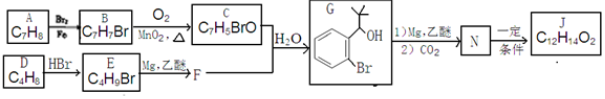

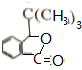 .
.
 反应①的反应条件和试剂分别为光照、Br2;L的结构简式为
反应①的反应条件和试剂分别为光照、Br2;L的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2在正极发生氧化反应 | |
| B. | 燃料电池的能量转化率可达100% | |
| C. | 工作一段时间后电解质溶液中OH-的物质的量浓度增大 | |
| D. | 产物为无污染的水,属于环境友好电池 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com