
【题目】25℃时,向0.1 mol/L醋酸中加入少量NaAc固体,肯定减小的是
A.c(H+)·c(OH-)B.溶液的导电能力C. D.c(OH-)
D.c(OH-)
【答案】C
【解析】
A. 水的离子积常数只与温度有关,温度不变,则Kw= c(H+)·c(OH-)不变,A不符合题意;
B. 向醋酸溶液中加入NaAc固体,醋酸的电离平衡逆向移动,醋酸电离产生的离子浓度减小,但盐的加入使溶液中自由移动的离子浓度增大,因此溶液的导电能力增强,B不符合题意;
C. 向0.1 mol/L醋酸中加入少量NaAc固体,醋酸的电离平衡逆向移动,醋酸分子浓度增大,醋酸根离子浓度增大,但平衡移动的趋势是微弱的,所以醋酸根离子浓度增大的比醋酸分子浓度增大的多,所以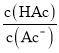 减小,C符合题意;
减小,C符合题意;
D. 向0.1 mol/L醋酸中加入少量NaAc固体,醋酸的电离平衡逆向移动,溶液中c(H+)减小,则由于c(H+)·c(OH-)不变,所以c(OH-)增大,D不符合题意;
故合理选项是C。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究温度对氨气还原 Fe2O3 的影响(固定装置略)。完成下列填空:

(1)实验时 A 中有大量紫红色的烟气,则 NH4I 的分解产物为 ___(至少填三种),E装置的作用是___。
(2)装置B中的反应方程式:______,D装置的作用是______。
某研究小组按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置 C 加热,反应产物均为黑色粉末(纯净物),两组分别用各自的产物进行以下探究,完成下列填空:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤 1 中溶液,滴加 KSCN 溶液 | 变红 | 无现象 |
3 | 向步骤 2 溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
(3)乙组得到的黑色粉末是______。
(4)甲组步骤1中反应的离子方程式为______。
(5)乙组步骤3中,溶液变红的原因为______;溶液褪色可能的原因及其验证方法为______。
(6)若装置C中Fe2O3反应后的产物是两种氧化物组成的混合物,为研究氧化物的组成,研究小组取样品7.84克在加热条件下通入氨气,完全反应后,停止加热,反应管中铁粉冷却后,称得质量为5.6克,则混合物的组成为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤废气中的氮氧化物(NOx)、CO2、SO2等气体,常要采用不同方法处理,以实现节能减排、废物利用等。
(1)下列为二氧化硫和氮的氧化物转化的部分环节:
①已知:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6 kJmol-1
2SO3(g) △H=-196.6 kJmol-1
2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0 kJ·mol-1
2NO2(g) △H=-113.0 kJ·mol-1
则SO2气体与NO2气体反应生成SO3气体和NO气体的热化学方程式为_________。
②一定条件下,工业上可通过下列反应实现燃煤烟气中液态硫的回收,其中Y是单质:SO2(g)+2CO(g) ![]() 2X(g)+Y(l)。为了测定在某种催化剂作用下的反应速率,某化学兴趣小组在某温度下、固定容器中用超灵敏气体传感器测得不同时间的SO2和CO浓度如下表:
2X(g)+Y(l)。为了测定在某种催化剂作用下的反应速率,某化学兴趣小组在某温度下、固定容器中用超灵敏气体传感器测得不同时间的SO2和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(SO2)/mol·L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
c(CO)/mol·L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
X的化学式为___________;当时间为第4 s时,2v(SO2)正____(填“>”“=”或“<”)v(X)逆。
(2)有科学家经过研究发现,在210~290℃、催化剂条件下用H2可将CO2转化生成甲醇蒸气和水蒸气。一定条件下,往2 L恒容密闭容器中充入1 mol CO2和3. 0 mol H2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示:
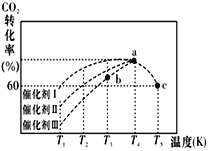
①催化剂效果最佳的是催化剂
②此反应在a点时已达平衡状态,a点的转化率比c点高的原因是___________。已知容器内的起始压强为100 kPa,则图中c点对应温度下反应的平衡常数Kp=______(保留两位有效数字)(Kp为以分压表示的平衡常数, 分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定化学用语正确的是( )
A. NaHCO3水解的离子方程式:HCO3-+H2O = CO32-+H3O+
B. Ba(OH)2的电离方程式:Ba(OH)2![]() Ba2++2OH-
Ba2++2OH-
C. NaHSO4在水中的电离方程式:NaHSO4= Na++H++SO42-
D. Na2S水解的离子方程式:S2-+2H2O = H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是( )

A.图中五点Kw间的关系B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显碱性
D.若从A点到C点,可用温度不变时在水中加入适量NH4Cl固体的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2,通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是( )

A.X、Y两端都必须用铁作电极
B.不可以用NaOH溶液作为电解液
C.阴极发生的反应是:2H++2e-=H2↑
D.白色沉淀只能在阳极上产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。

完成下列填空:
(1)写出电解饱和食盐水的离子方程式___。
(2)精制饱和食盐水从图中___位置补充,氢氧化钠溶液从图中___位置流出(选填“a”、“b”、“c”或“d”)。
(3)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
写出该反应的化学方程式___。
(4)室温下,0.1mol/LNaClO溶液的pH___0.1mol/LNa2SO3溶液的pH(选填“大于”、“小于”或“等于”)。
(5)浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为___。
已知:H2SO3:Ki1=1.54×102,Ki2=1.02×107,HClO:Ki1=2.95×108,H2CO3:Ki1=4.3×107,Ki2=5.6×1011。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CO、H2和CO2组成的混合气体116.8 L(标准状况),经完全燃烧后放出的总能量为867.9 kJ,并生成18 g液态水。已知2H2(g)+O2(g)======2H2O(l)ΔH=-571.6 kJ·mol-1;2CO(g)+O2(g) ======2CO2(g) ΔH=-566 kJ·mol-1。则燃烧以前混合气体CO的体积分数最接近于 ( )
A.80%B.60%C.40%D.20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.新制的氯水放置一段时间,溶液的pH会减小
B.在配制硫酸亚铁溶液时往往要加入少量铁粉
C.恒容容器中反应CO(g)+NO2(g)![]() CO2(g)+NO(g) △H<0达到平衡后,升高温度,气体颜色变深
CO2(g)+NO(g) △H<0达到平衡后,升高温度,气体颜色变深
D.增大压强,有利于SO2与O2反应生成SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com