
A、电解饱和食盐水2H++2Cl?
| ||||
| B、向NH4HSO3溶液中滴入足量NaOH溶液:HSO3-+OH-=SO32-+H2O | ||||
| C、向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | ||||
| D、足量AlCl3溶液与小苏打溶液混合:Al3++3HCO3-═Al(OH)3↓+3CO2↑ |
| ||
| ||


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
| A、减少对环境的污染 |
| B、防患于未然,最终杜绝化学污染源 |
| C、设计对人类健康和环境更安全的化合物 |
| D、研究变换基本原料和起始化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HX一定是弱酸 |
| B、NaX水溶液的碱性弱于NaY水溶液的碱性 |
| C、HX一定是强酸 |
| D、反应过程中二者生成H2的速率相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④>①>③>② |
| B、①>④>③>② |
| C、①>②>③>④ |
| D、④>③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O |
| B、铁和稀盐酸反应:Fe+2H+=H2↑+Fe2+ |
| C、氢氧化钡溶液与稀H2SO4 反应:Ba2++SO42-=BaSO4↓ |
| D、钠投入水中:Na+H2O=Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由2H和18O组成的水11 g,所含的中子数为4NA |
| B、标准状况下11.2 L乙烷和乙烯的混合气体中含有C原子数为NA |
| C、在0.1 mol?L-1的醋酸溶液中,所含H+的个数小于0.1NA |
| D、室温下H2O2分解得到16 g O2,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
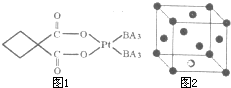 由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+61Ns1,回答下列问题.
由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+61Ns1,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com