
下列有关阿伏加德罗常数(NA)的说法错误的是( )
A.常温常压下14克CO所含的原子数目为NA个
B.标准状况下0.8molCCl4含有的原子数目为4NA个
C.任何条件下0.5mol氮气分子的分子数一定是0.5NA
D.49克硫酸中含有的原子数目为0.5NA
科目:高中化学 来源: 题型:
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
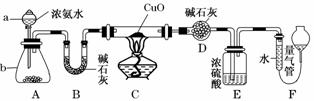
(1)仪器a的名称为________;仪器b中可选择的试剂为________。
(2)实验室中,利用装置A还可制取的无色气体是________(填字母)
A.Cl2 B.O2
C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有________性,写出相应的化学方程式___________________________
________________________________________________________________________。
(4)E装置中浓硫酸的作用______________________________________________。
(5)读取气体体积前,应对装置F进行的操作:________________________________
________________________________________________________________________。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
环己烯可以通过丁二烯与乙烯发生环化加成反应得到:
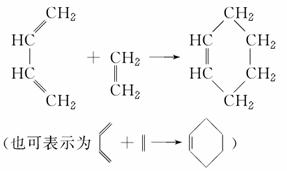
实验证明,下列反应中反应物分子的环外双键比环内双键更容易被氧化: 。现仅以丁二烯为有机原料,无机试剂任选,按下列途径合成甲基环己烷:
。现仅以丁二烯为有机原料,无机试剂任选,按下列途径合成甲基环己烷:
丁二烯
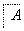




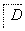


请按要求填空:
(1)A的结构简式为________;B的结构简式为_______________________。
(2)写出下列反应的化学方程式和反应类型。
反应④_________________________________________,
反应类型________;
反应⑤________________________________,
反应类型________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应中不能发生的是( )
A.2Fe3++SO2+2H2O===2Fe2++SO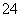 +4H+
+4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.H2O2+H2SO4===SO2↑+O2↑+2H2O
D.2Fe2++Cl2===2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
①1mol氧元素 ②0.25mol氯离子 ③0. 5mol 氢分子
④氢氧化钠的摩尔质量是40g/mol
⑤0.1mol水分子中含有NA个质子和NA个电子
⑥0.25mol 氨气在标准状况下体积约为5.6升。
A. 全部正确 B.②③④⑤⑥ C.①②③④⑥ D.①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,肯定不能共存的是( )
A. Fe3+、NO3、Cl、Na+ B.Ba2+、Mg2+、HCO3、AlO2
C.NO3、Na+、K+、CO32 D.NO3、K+、AlO2、OH
查看答案和解析>>
科目:高中化学 来源: 题型:
把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铝的质量分数为 ( )
A.70% B. 52.4% C.47.6% D.30%
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.1mol/L的CH3COOH溶液中存在如下电离平衡:
CH3COOH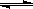 CH3COO-+H+ 对于该平衡,下列叙述正确的是( )
CH3COO-+H+ 对于该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,平衡向逆反应方向移动
B.升高温度,平衡向正反应方向移动
C.加入水稀释,溶液中c(H+)一定增大
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:
(2)H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①(H3PO2)中,磷元素的化合价为
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为: (填化学式);依据所学关于电镀的原理,分析该电镀过程中可选用的电极材料为阳极: ;阴极: 。
③NaH2PO2是 (填“正盐”还是“酸式盐”),其溶液显 性(填“弱酸性”、“中性”、或者“弱碱性”),其溶液中离子浓度由大到小的顺序应
 为
为
(3)(H3PO2)也可以通过电解的方法制备。
工作原理如图所示(阳膜和阴膜分别只允许阳离子、
阴离子通过):
①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com