
茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是

A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+,选用③、⑧和⑩
科目:高中化学 来源:2015届湖北省高一上学期期中考试化学试卷(解析版) 题型:填空题
(1)某0.2 L,浓度为c的BaCl2溶液中含1 mol Cl-,则c= mol/L。
(2)已知16gA和20gB恰好完全反应生成0.04mol C和31.76gD,则C的摩尔质量为
(3)经测定0.1 mol/L的KHSO4溶液与0.1 mol/L的盐酸中的氢离子浓度几乎相同,则该浓度的KHSO4 溶液与铁粉反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省四校高三上学期期中联考化学试卷(解析版) 题型:填空题
(10分) 中学常见化学反应方程式为:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为1:4。请回答:
(1)若Y为黄绿色气体,该反应的离子方程式为 ,B体现出的化学性质有 。
(2)若A为常见的非金属单质,B的溶液为某浓酸,反应条件为加热,其反应的化学方程式为 。
(3)若A为某不活泼的金属单质,该反应能产生一种造成光化学烟雾的气体,该反应中氧化剂与还原剂的物质的量之比为 。
(4)若A为常见的金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。写出A与X的溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省四校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列判断不合理的是( )
A.能电离出H+的物质一定是酸
B.焰色反应是物理变化
C.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
D.蔗糖、碳酸钡和水分别属于非电解质、强电解质和弱电解质
查看答案和解析>>
科目:高中化学 来源:2015届湖北省咸宁市高三三校联考化学试卷(解析版) 题型:填空题
(6分)A、B、C、D、E、F六种原子序数依次增大的短周期元素。A与其余五种元素既不同周期,也不同主族;B、C、D、E、F五种元素分别位于五个相邻的主族,原子序数之和为54,其中B的单质为空气中的主要成分之一。
(1)A、B形成的化合物液态时可发生微弱电离,电离产生的阴离子的电子式为_______________。
(2)某含F的盐矿石的组成可以看作其氧化物中有1/4的F被E替换,再由D平衡其电荷形成的。该矿石的化学式为 。(用氧化物形式表示)
(3)工业中制备单质E的阳极电极反应式: 。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省咸宁市高三三校联考化学试卷(解析版) 题型:选择题
一定条件下,2SO2(g)+O2(g)  2SO3(g) ΔH=-197 kJ·mol-1。现有容积固定且相同的五个容器,在上述条件下分别充入的气体和反应热ΔH如表所示:
2SO3(g) ΔH=-197 kJ·mol-1。现有容积固定且相同的五个容器,在上述条件下分别充入的气体和反应热ΔH如表所示:
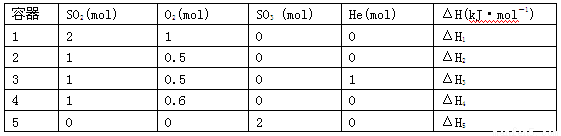
根据以上数据,下列选项正确的是
A.ΔH1=2ΔH2 B.ΔH3<ΔH4 C.ΔH1+ΔH5=197 D.ΔH2=ΔH3
查看答案和解析>>
科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:填空题
25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是________________;(填编号)
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是_____;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,理由是__________________,

稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”),理由是:__________________;
(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=________。(填准确数值)
查看答案和解析>>
科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:选择题
下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN—
B.在强碱溶液中:Na+、K+、AlO2—、CO32—
C.在c(H+) =10—13mol/L 的溶液中:NH4+、Al3+、SO42—、NO3—
D.在pH =1的溶液中:K+、Fe2+、Cl—、NO3—
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:选择题
已知:(1)Al(OH)3的电离方程式为:AlO2-+H++H2O Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-
(2)无水AlCl3晶体的沸点为182.9℃,溶于水的电离方程式为:AlCl3=Al3++3Cl-
(3)PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:
PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb
则下列关于Al(OH)3、AlCl3和(CH3COO)2Pb的说法中正确的是 ( )
A.均为强电解质 B.均为弱电解质 C.均为离子化合物 D.均为共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com