
| ��Ӧʱ�� | CO2��mol�� | H2��mol�� | CH3OH��mol�� | H2O��mol�� | |
| ��Ӧ���º��� | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| ��Ӧ���Ⱥ��� | 0min | 0 | 0 | 2 | 2 |
���� ��H2��ȼ����Ϊ285.8kJ•mol-1����٣� 2H2��g��+O2��g��=2H2O��l����H=-571.6kJ•mol-1��
�ڣ�N2��g��+2O2��g��=2NO2��g����H=+133kJ•mol-1
�ۣ�H2O��g��=H2O��l����H=-44kJ•mol-1
���ݸ�˹���ɣ��١�2-��-�ۡ�4�ɵã�4H2��g��+2NO2��g��=N2��g��+4H2O��g������Ӧ��Ҳ������Ӧ�ļ��㣻
��1�����Է����е��ж������ǡ�H-T��S��0����Ϸ�Ӧ���������ж���Ҫ��������
�ڿ��ܷ�Ӧ����ƽ��ʱ�����淴Ӧ������ȣ�����ֵ�Ũ�ȡ��������䣬�ɴ�����������һЩ���������䣬�ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����仯��˵������ƽ�⣻
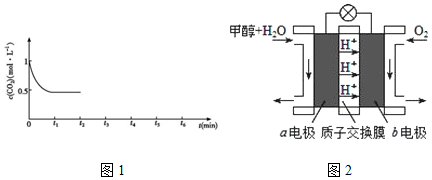
��t2ʱCO2Ũ��Ϊ0.5mol/L��������Ũ�ȱ仯��Ϊ��1mol/L-0.5mol/L����3=1.5mol/L������ƽ��Ũ��Ϊ$\frac{6mol}{2L}$-1.5mol/L=1.5mol/L������¶���ƽ�ⳣ��K=$\frac{1}{0.5��1��{5}^{3}}$��
��t2ʱ�������ݻ���Сһ����˲��CO2Ũ�ȱ�Ϊ1mol/L��ѹǿ����ƽ��������Ӧ�����ƶ���t3ʱ�ﵽƽ��ʱ����ЧΪ��ʼ�����Сһ�������ƽ�⣬���ʱCO2Ũ��Ϊxmol/L����
CO2��g��+3H2��g��?CH3OH��l��+H2O��l��
��ʼ��mol/L����2 6
ת����mol/L����2-x 6-3x
ƽ�⣨mol/L����x 3x
��$\frac{1}{x����3x��^{3}}$=$\frac{1}{0.5��1��{5}^{3}}$�����x=0.5��
t3ʱ�ﵽƽ��ʱCO2Ũ��Ϊ0.5mol/L��t4ʱ�����¶ȣ�˲��CO2Ũ�Ȳ��䣬����ӦΪ���ȷ�Ӧ������ƽ��������Ӧ�ƶ���CO2Ũ�ȼ�С��
��2����IΪ���£���Ϊ������������Ӧ���淴Ӧ���У��淴ӦΪ���ȷ�Ӧ��ƽ��ʱ�¶ȱ�I�еͣ������¶�ƽ�����淴Ӧ�����ƶ����ɴ��ж�ƽ�ⳣ����ƽ��ʱCH3OH��Ũ�ȴ�С��
�۸���v=$\frac{��c}{��t}$����v��H2�����ٸ�������֮�ȵ��ڻ�ѧ������֮�ȼ���v��CH3OH����
20minʱ��ת����CO2Ϊ2mol-1mol=1mol�������ɵ�CH3OHΪ1mol����30minʱCH3OHΪ1mol����20minʱ����ƽ�⣬����ƽ��ʱ�����Ũ�ȣ�����ƽ�ⳣ������ʽK=$\frac{c��C{H}_{3}OH����c��{H}_{2}O��}{c��C{O}_{2}����{c}^{3}��{H}_{2}��}$���㣻ƽ��ʱ����Ϊ6mol-1mol��3=3mol������ƽ��Ũ��Ϊ$\frac{3mol}{2L}$=1.5mol/L���������������䣬ֻ�ı��¶�T2�棬��ʱH2�����ʵ���Ϊ3.2mol��˵���¶ȸı䣬ƽ�������ƶ����˷�Ӧ������Ϊ���ȷ�Ӧ���ɴ��ж������»��ǽ��£�����Ũ����Qc����ƽ�ⳣ���Ƚ��ж�ƽ���Ƿ��ƶ���
��3����2�������������϶�����̼�õ��Ӻ������ӷ�Ӧ����HCOOH��
��1�缫�Ǹ�����ˮʧ�������������Ӻ�������
��� �⣺��H2��ȼ����Ϊ285.8kJ•mol-1����٣� 2H2��g��+O2��g��=2H2O��l����H=-571.6kJ•mol-1��
�ڣ�N2��g��+2O2��g��=2NO2��g����H=+133kJ•mol-1
�ۣ�H2O��g��=H2O��l����H=-44kJ•mol-1
���ݸ�˹���ɣ��١�2-��-�ۡ�4�ɵã�4H2��g��+2NO2��g��=N2��g��+4H2O��g����
��H=2����-571.6kJ•mol-1��-133kJ•mol-1-4����-44kJ•mol-1��=-1100.2kJ•mol-1��
�ʷ�Ӧ�Ȼ�ѧ����ʽΪ��4H2��g��+2NO2��g��=N2��g��+4H2O��g����H=-1100.2kJ•mol-1��
�ʴ�Ϊ��4H2��g��+2NO2��g��=N2��g��+4H2O��g����H=-1100.2kJ•mol-1��
��1����CO2��g��+3H2��g���TCH3OH��l��+H2O��l�����ر��S��0����Ӧ�ʱ��H��0�������������H-T��S��0
�ʴ�Ϊ�����£�
��a���״���ˮΪҺ�壬CO2��H2����ʼ���ʵ���֮��Ϊ1��3����Ӧ�����ʵ���1��3��Ӧ���ʻ��������CO2��H2����ʼ���ʵ���֮��Ϊ1��3��ƽ��Ħ��������ֵ��ƽ����Է�������ʼ�ձ��ֲ��䣬���ж���ƽ��״̬����a����
b����a�з�������֪CO2��H2�����������ֵʼ�ձ��ֲ��䣬���ж���ƽ��״̬����b����
c����a�з�������֪CO2��H2��ת����ʼ����ȣ����ж���ƽ��״̬����c����
d�������ݻ����䣬�������������С���淴Ӧ���л�������ܶȼ�С�������������ܶȲ��䣬��Ӧ����ƽ�⣬��d��ȷ��
e.1molCO2���ɵ�ͬʱ��3molH-H�����ѣ���1molCO2���ɵ�ͬʱ����3molH-H������������������������������ȣ���Ӧ����ƽ�⣬��e��ȷ��
��ѡ��de��
��t2ʱCO2Ũ��Ϊ0.5mol/L��������Ũ�ȱ仯��Ϊ��1mol/L-0.5mol/L����3=1.5mol/L������ƽ��Ũ��Ϊ$\frac{6mol}{2L}$-1.5mol/L=1.5mol/L������¶���ƽ�ⳣ��K=$\frac{1}{0.5��1��{5}^{3}}$��
��t2ʱ�������ݻ���Сһ����˲��CO2Ũ�ȱ�Ϊ1mol/L��ѹǿ����ƽ��������Ӧ�����ƶ���t3ʱ�ﵽƽ��ʱ����ЧΪ��ʼ�����Сһ�������ƽ�⣬���ʱCO2Ũ��Ϊxmol/L����
CO2��g��+3H2��g��?CH3OH��l��+H2O��l��
��ʼ��mol/L����2 6
ת����mol/L����2-x 6-3x
ƽ�⣨mol/L����x 3x
��$\frac{1}{x����3x��^{3}}$=$\frac{1}{0.5��1��{5}^{3}}$�����x=0.5��
t3ʱ�ﵽƽ��ʱCO2Ũ��Ϊ0.5mol/L��t4ʱ�����¶ȣ�˲��CO2Ũ�Ȳ��䣬����ӦΪ���ȷ�Ӧ������ƽ��������Ӧ�ƶ���CO2Ũ�ȼ�С������t2��t6CO2��Ũ����ʱ��ı仯��ͼ��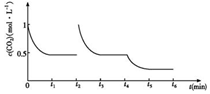
�ʴ�Ϊ�� ��
��
��2����IΪ���£���Ϊ������������Ӧ���淴Ӧ���У��淴ӦΪ���ȷ�Ӧ��ƽ��ʱ�¶ȱ�I�еͣ������¶�ƽ�����淴Ӧ�����ƶ�������ʱƽ�������ƶ�����ƽ�ⳣ��K����K����ƽ��ʱCH3OH��Ũ��c��I����c����
�ʴ�Ϊ����������
��v��H2��=$\frac{\frac{6mol-4.5mol}{2L}}{10min}$=0.075mol/��L��min��������֮�ȵ��ڻ�ѧ������֮�ȣ�v��CH3OH��=$\frac{1}{3}$v��H2��=0.025mol/��L•min����
20minʱ��ת����CO2Ϊ2mol-1mol=1mol�������ɵ�CH3OHΪ1mol����30minʱCH3OHΪ1mol����20minʱ����ƽ�⣬
CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ��mol/L����2 6 0 0
ת����mol/L����1 3 1 1
ƽ�⣨mol/L����1 3 1 1
��ƽ�ⳣ��K=$\frac{c��C{H}_{3}OH����c��{H}_{2}O��}{c��C{O}_{2}����{c}^{3}��{H}_{2}��}$=$\frac{\frac{1}{2}��\frac{1}{2}}{\frac{1}{2}����{\frac{3}{2}��}^{3}}$=$\frac{4}{27}$��
ƽ��ʱ����Ϊ6mol-1mol��3=3mol������ƽ��Ũ��Ϊ$\frac{3mol}{2L}$=1.5mol/L���������������������£���30minʱֻ�ı��¶�T2�棬��ʱH2�����ʵ���Ϊ3.2mol��ƽ�������ƶ�������Ũ��������������ӦΪ���ȷ�Ӧ�����������¶ȣ���T1��T2���Է�Ӧ����30minʱֻ���������ٳ���1molCO2��g����1molH2O��g������ʱŨ����Qc=$\frac{\frac{1}{2}��\frac{2}{2}}{\frac{2}{2}����\frac{3}{2}��^{3}}$=$\frac{4}{27}$=K=$\frac{4}{27}$����ƽ�ⲻ�ƶ���
�ʴ�Ϊ��0.025mol/��L•min������������
��3����2�������������϶�����̼�õ��Ӻ������ӷ�Ӧ����HCOOH���缫��ӦʽΪCO2+2H++2e-=HCOOH���ʴ�Ϊ��CO2+2H++2e-=HCOOH��
�ڵ缫1ʽΪ�����������ĵ缫��ӦʽΪ2H2O-4e-=4H++O2�������������ŵ��缫2����11.2L CO2��Ӧ��������̼�����ʵ���Ϊ$\frac{11.2L}{22.4L/mol}$=0.5mol��ת�Ƶ���Ϊ0.5mol��2=1mol���缫1�Ҳμӷ�Ӧ��ˮ������Ϊ18g/mol��$\frac{1mol}{2}$=9g��
���缫1�����ۼ�СҺ������Ϊ9g��
�ʴ�Ϊ����С��9��
���� ���⿼�黯ѧƽ���йؼ��㡢ƽ��Ӱ�����ء���ѧƽ��״̬�жϡ�ƽ�ⳣ�����Ȼ�ѧ����ʽ��д�����͵�ع���ԭ��������ȣ���Ŀ����ͼΪ�״��㣬ѧ�����������ѹ��һ����ƽ��ʱ������̼�ľ���Ũ�ȣ��Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������һ��ֻ����Ԫ�� | B�� | ������һ������Ԫ�أ�û�м�Ԫ�� | ||
| C�� | ����ȷ�����������Ƿ�Ԫ�� | D�� | ������һ���ǽ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢۢ� | B�� | �٢ڢ� | C�� | �ڢۢܢ� | D�� | �٢ڢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ԭ������ԭ�ӷ�Ӧ����NaCl����ṹ���ȶ�����ǿ | |
| B�� | ����������֮����ǿ�ҵ��������ö�û���ų����ã��������Ӽ��ĺ˼�����൱С | |
| C�� | ʧ�����ѵ�ԭ�ӻ�õ��ӵ�����һ��ǿ | |
| D�� | �κ����Ӽ����γɵĹ����бض��е��ӵĵ���ʧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ꡢ����ЧӦ���⻯ѧ���� | B�� | ���ꡢ������ն����⻯ѧ���� | ||
| C�� | ˮ����������ն����⻯ѧ���� | D�� | ���ꡢ������ն�����ɫ��Ⱦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
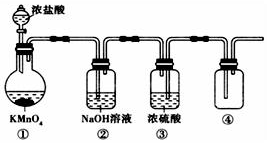 ������أ�KMnO4����Ũ�������Ⱦ��ܷ�����Ӧ����Cl2��������ͼ��ʾ��ʵ��װ���Ʊ������������Cl2�������д����װ���ǣ�������
������أ�KMnO4����Ũ�������Ⱦ��ܷ�����Ӧ����Cl2��������ͼ��ʾ��ʵ��װ���Ʊ������������Cl2�������д����װ���ǣ�������| A�� | �٢� | B�� | �� | C�� | �ڢ� | D�� | �ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��ʼ���ʵ��� | �� | �� | �� |
| n��H2��/mol | 1 | 2 | 2 |
| n��I2��/mol | 1 | 1 | 2 |
| A�� | ƽ��ʱ�����л�������ƽ��Ħ�������Ǽ��е�2�� | |
| B�� | ƽ��ʱ��������HI�����ʵ���n��������2n���ң� | |
| C�� | ƽ��ʱ������I2��ת���ʴ���80% | |
| D�� | ��Ӧ��ʼʱ�����еķ�Ӧ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
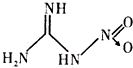 ��������������ά��ҩ���������ͻ�ҩ�IJ��ϼ����������ƽ�������Ҫ��֣���ṹ��ͼ��ʾ����������һ������Ĺ��۵������������й������ҵ�˵����ȷ���ǣ�������
��������������ά��ҩ���������ͻ�ҩ�IJ��ϼ����������ƽ�������Ҫ��֣���ṹ��ͼ��ʾ����������һ������Ĺ��۵������������й������ҵ�˵����ȷ���ǣ�������| A�� | �����ҷ�����ֻ�����Լ��������Ǽ��Լ� | |
| B�� | ����������C��H��O��N����Ԫ�أ����ڰ����� | |
| C�� | �����ҷ����ЦҼ���м��ĸ�������5��1 | |
| D�� | 10.4 g�����ʺ���1.1��6.02��1023��ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
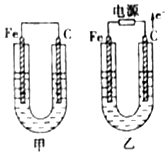 �ס������ص缫���϶���������̼������ش��������⣺
�ס������ص缫���϶���������̼������ش��������⣺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com