
已知某温度下,Ka(HCN)=6.2×10-10 mol/L、Ka(HF)=6.8×10-4 mol/L、Ka(CH3COOH)=1.8×10-5 mol/L、Ka(HNO2)=6.4×10-6 mol/L。物质的量浓度都为0.1 mol/L的下列溶液中,pH最小的是( )
A.HCN溶液 B.HF溶液
C.CH3COOH溶液 D.HNO2溶液
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 常温常压下,48 g O2和48 g O3 含有的氧原子数均为3NA
B.1 mol∙L−1 NaCl溶液中含有Na+的个数为NA
C.22.4L N2所含分子数为NA
D.标准状况下,22.4 L的水中含有NA个H2O分子
查看答案和解析>>
科目:高中化学 来源: 题型:
某地在整顿音像市场的活动中,查获了一大批盗版光盘,并进行了“绿色销毁”。以下做法中,属于“绿色销毁”的是( )
A.泼上汽油焚烧
B.倾倒入江河中
C.深埋于土中
D.碾压粉碎后再回收利用
查看答案和解析>>
科目:高中化学 来源: 题型:
斯坦福大学B.M.Trost教授提出了绿色化学的核心概念——原子经济性。我们常用原子利用率来衡量化学反应过程的原子经济性,其计算公式为:原子利用率=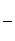 ×100%
×100%
下面是新型自来水消毒剂ClO2的四种生产方法,请填空:
(1)氯酸钠和盐酸法:本方法的方程式为2NaClO3+4HCl 2NaCl+2ClO2↑+Cl2↑+2H2O,此方法的原子利用率为________%(保留一位小数,下同)。
2NaCl+2ClO2↑+Cl2↑+2H2O,此方法的原子利用率为________%(保留一位小数,下同)。
(2)电解亚氯酸钠法:本方法是用惰性电极电解亚氯酸钠溶液,原子利用率为62.2%,其阳极电极反应式为:ClO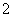 -e-
-e- ClO2,阴极电极反应式为_______________。
ClO2,阴极电极反应式为_______________。
(3)亚氯酸钠和氯气法:本方法的原子利用率为53.6%,此反应的化学方程式为____________________。
(4)联合工艺法:本方法的反应原理由三步组成:
①电解氯化钠溶液NaCl+3H2O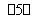 NaClO3+3H2↑
NaClO3+3H2↑
②氢气和氯气合成氯化氢
③生成二氧化氯2NaClO3+4HCl 2NaCl+2ClO2↑+Cl2↑+2H2O此方法的原子利用率最大为________%。
2NaCl+2ClO2↑+Cl2↑+2H2O此方法的原子利用率最大为________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
某一元弱酸(用HA表示)在水中的电离方程式是:HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向________(填“正”、“逆”)反应方向移动,理由是________________________________。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向________(填“正”、“逆”)反应方向移动,溶液中c(A-)将________(填“增大”、“减小”或“不变”),溶液中c(OH-)将________(填“增大”、“减小”或“不变”)。
(3)在25℃下,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),则溶液显________性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=____________。
)=c(Cl-),则溶液显________性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,反应:2A(s)+2B(g)  C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是
A. 单位时间内生成2a mol B,同时生成a molD
B. C的质量不再改变
C. 容器内的压强不随时间而变化
D. 混合气体的密度不再随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
关于绿色化学的叙述错误的是( )
A.采用无毒无害的原料,生产有利环保、人体健康、安全的产品
B.在无毒、无害的条件下反应,减少废物向环境排放
C.充分利用能源、资源,提高原子利用率、使原料的原子都成为产品
D.充分利用绿色原料进行化工生产,产出绿颜色产品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com