
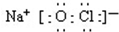 ;若将84消毒液长期露置于空气中,溶液中的主要成分最终将变为NaCl.(填化学式)
;若将84消毒液长期露置于空气中,溶液中的主要成分最终将变为NaCl.(填化学式)分析 (1)根据次氯酸钠是离子化合物,氧原子和氯原子共用1对共用电子对;84消毒液有效成分NaClO,长期露置于空气中,发生反应:2NaClO+CO2+H2O=Na2CO3+2HClO,2HClO$\frac{\underline{\;光照\;}}{\;}$2 HCl+O2↑,Na2CO3+2HCl=2NaCl+CO2↑+H2O,最终会变为NaCl溶液;
(2)次氯酸钠有强氧化性,盐酸有强还原性,两者相遇发生氧化还原反应生成氯气;
(3)上述反应为氧化还原反应中的归中反应,同种元素变化后的化合价相等.
(4)电子守恒得到的电子数与质量之间的关系式计算.
解答 解:(1 )次氯酸钠是离子化合物,氧原子和氯原子共用1对共用电子对,电子式为: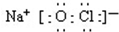 ;84消毒液有效成分NaClO,长期露置于空气中,发生反应:2NaClO+CO2+H2O=Na2CO3+2HClO,2HClO$\frac{\underline{\;光照\;}}{\;}$2 HCl+O2↑,Na2CO3+2HCl=2NaCl+CO2↑+H2O,最终会变为NaCl溶液,溶液中的主要成分将变为NaCl;
;84消毒液有效成分NaClO,长期露置于空气中,发生反应:2NaClO+CO2+H2O=Na2CO3+2HClO,2HClO$\frac{\underline{\;光照\;}}{\;}$2 HCl+O2↑,Na2CO3+2HCl=2NaCl+CO2↑+H2O,最终会变为NaCl溶液,溶液中的主要成分将变为NaCl;
故答案为: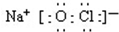 ;NaCl;
;NaCl;
(2)次氯酸钠有强氧化性,盐酸有强还原性,两者相遇发生氧化还原反应生成氯气,方程式为:NaClO+2HCl═NaCl+Cl2↑+H2O,离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O,故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;
(3)上述反应为氧化还原反应中的归中反应,同种元素变化后的化合价相等,
A.Na2S2O3+H2SO4→Na2SO4+S+SO2+H2O中硫元素变化后的化合价不相等,故A选;
B.2FeCl3+Fe→2FeCl2中铁元素变化后的化合价相等,故B不选;
C.S+2H2SO4(浓)$\stackrel{△}{→}$3SO2+2H2O中硫元素变化后的化合价相等,故C不选;
D.KClO3+5KCl+3H2SO4→3K2SO4+3Cl2+3H2O中氯元素变化后的化合价相等,故D不选;
故答案为:A;反应为氧化还原反应中的归中反应,同种元素变化后的化合价相等;
(4)NaClO、ClO2、Cl2、Ca(ClO)2作消毒剂时,其还原产物均为Cl-,根据单位质量得到的电子数分别为:$\frac{2{N}_{A}}{74.5}$、$\frac{5{N}_{A}}{67.5}$、$\frac{2{N}_{A}}{71}$、$\frac{4{N}_{A}}{143}$,得到的电子数最大的是ClO2,
故答案为:B.
点评 本题综合考查氯的化合物的性质以及卤素的性质比较,题目较为综合,难度较大,注意把握题给信息,尤其是氧化还原反应知识的运用.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 失去电子的反应是还原反应 | B. | 发生氧化反应的是氧化剂 | ||
| C. | 作氧化剂的物质不能同时作还原剂 | D. | 失去电子的物质是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,氧化产物是K2SO3,氧化剂与还原剂的物质的量之比为2:1,若反应中消耗了0.6molS,则反应中转移的电子为0.8mol.
,氧化产物是K2SO3,氧化剂与还原剂的物质的量之比为2:1,若反应中消耗了0.6molS,则反应中转移的电子为0.8mol.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,该化合物是由离子键形成的.
,该化合物是由离子键形成的.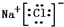 、
、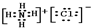 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com