
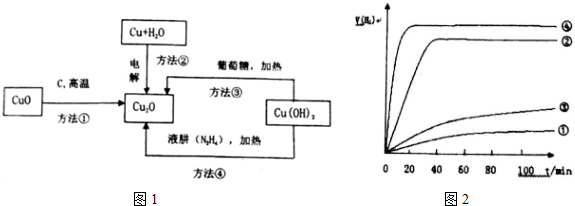
分析 (1)用方法①制取Cu2O时产生有毒气体为CO,
已知:Ⅰ.2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-169kJ•mol-1,
Ⅱ.C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1,
Ⅲ.Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-157kJ•mol-1
根据盖斯定律,Ⅱ-Ⅲ×2-$\frac{1}{2}$×Ⅰ可得:C(s)+2CuO (s)=Cu2O(s)+CO(g);
(2)根据Cu元素化合价变价计算转移电子数目;在电解池的阳极发生失电子的氧化反应,Cu失去电子,碱性条件下生成Cu2O与H2O,阴极上发生还原反应,水放电生成氢气与氢氧根离子;
(3)液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,由守恒可知还生成水;
(4)A.温度影响催化剂的活性;
B.曲线斜率越大,反应速率越大,用不同的方法制备的氧化亚铜的颗粒大小不同;
C.②④曲线斜率较大,说明反应速率较大,催化效果好;
D.催化剂不影响平衡移动.
解答 解:(1)用方法①制取Cu2O时产生有毒气体为CO,
已知:Ⅰ.2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-169kJ•mol-1,
Ⅱ.C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1,
Ⅲ.Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-157kJ•mol-1
根据盖斯定律,Ⅱ-Ⅲ×2-$\frac{1}{2}$×Ⅰ可得:C(s)+2CuO (s)=Cu2O(s)+CO(g)△H=+34.5kJ•mol-1,
故答案为:C(s)+2CuO (s)=Cu2O(s)+CO(g)△H=+34.5kJ•mol-1;
(2)根据Cu元素化合价变价,可知转移电子数目为0.1mol×2×(1-0)=0.2mol,
在电解池的阳极发生失电子的氧化反应,Cu失去电子,碱性条件下生成Cu2O与H2O,阴极上发生还原反应,水放电生成氢气与氢氧根离子,则阴极负极pH值增大,阳极电极反应式为:2Cu-2e-+2OH-=Cu2O+H2O,
故答案为:0.2;增大;2Cu-2e-+2OH-=Cu2O+H2O;
(3)液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,由元素守恒可知还生成水,反应化学方程式为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O,
故答案为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O;
(4)A.温度影响催化剂的活性,Cu2O催化水分解时,需要适宜的温度,故A正确;
B.用不同的方法制备的氧化亚铜的颗粒大小不同,由图象可知催化效果不同,则催化效果与Cu2O颗粒的粗细、表面活性等有关,故B正确;
C.②④曲线斜率较大,说明反应速率较大,则②④方法制得的Cu2O催化效率相对较高,故C正确;
D.催化剂只改变反应速率,不影响平衡移动,故D错误.
故答案为:D.
点评 本题考查物质制备方案,涉及热化学方程式、陌生方程式书写、电解原理、氧化还原反应、化学平衡以及反应速率的影响等知识,侧重于学生的分析能力的考查,题目难度中等.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:推断题
 .
. ,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
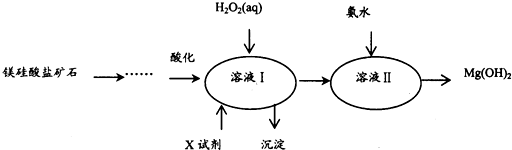
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
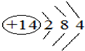 .
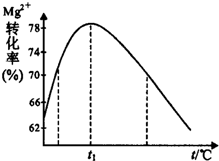
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验溴乙烷中的溴:取溴乙烷加氢氧化钠溶液,加热,再加硝酸银溶液有浅黄色沉淀生成 | |
| B. | 检验葡萄糖:在硝酸银溶液中滴加稀氨水至沉淀恰好溶解再加少许葡萄糖溶液,水浴加热 | |
| C. | 检验乙醛:加入2% 硫酸铜溶液2 mL再加入2% NaOH溶液2 mL;加热至沸腾 | |
| D. | 实验室制乙烯:取浓硫酸和乙醇体积比1:3的溶液加热到170℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
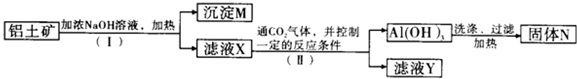
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的物质的量浓度 | B. | 混合气体的压强 | ||
| C. | 混合气体总物质的量 | D. | v(C)与v(D)的比值 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液很快褪色 | B. | 溶液不褪色 | C. | 出现沉淀 | D. | 不出现沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com