
下列指定反应的离子方程式正确的是
A.用醋酸溶解大理石:CaCO3+2H+=Ca2++H2O+CO2↑
B.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O=AlO-2+4NH+ 4+2H2O
C.向碳酸氢钙溶液中加入少量烧碱溶液:
Ca2++2HCO-3+2OH-=CaCO3↓+CO2-3+H2O
D.亚硫酸钠溶液中滴加酸性高锰酸钾溶液:
5SO2-3+6H++2MnO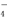 =5SO2-4+2Mn2+ +3H2O
=5SO2-4+2Mn2+ +3H2O
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA | |
| B. | NA个Fe(OH)3胶体粒子的质量为107g | |
| C. | 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA | |
| D. | 2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0.2NA之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③④ | C. | ①② | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:实验题
某化工厂用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS)联合生产Zn、MnO2,其部分生产流程如下:
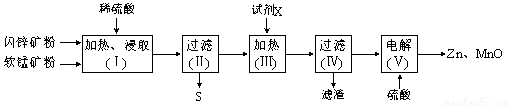
已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
(1)加热、浸取时所加矿石均需粉碎,其目的是 。
(2)写出FeS和MnO2和稀硫酸反应的离子方程式: 。
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3。pH调节的范围是 ,试剂X可以选用 (填选项字母)。
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3·H2O
(4)电解(Ⅴ)中阳极的电极反应式为 。
(5)Zn和MnO2是制作电池的原料。某锌-锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。该电池的正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
通过乙醇制取氢气通常有如下两条途径:
a.CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g) ΔH1=+256.6 kJ·mol-1
b.2CH3CH2OH(g)+O2(g)=6H2(g)+4CO(g) ΔH2=+27.6 kJ·mol-1
则下列说法正确的是
A.升高a的反应温度,乙醇的转化率增大
B.由b可知:乙醇的燃烧热为13.8 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(g) ΔH=+485.6 kJ·mol-1
D.制取等量的氢气,途径b消耗的能量更多
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
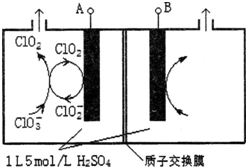 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径 (10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
 ;
;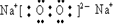 .
. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | NH4HSO3受热分解产生的气体全部通入Ba(NO3)2溶液中 | 产生白色沉淀 | 沉淀为BaSO4 |
| B | 浓度均为0.1mol•L-1Zn2+和Cu2+混合溶液中滴入少量Na2S溶液 | 产生黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
| C | 2mLpH=3的盐酸和2mLpH=3醋酸,同时分别加入足量相同的锌粉 | 反应速率不同 | 较快的为盐酸 |
| D | 待测液X中加入KSCN溶液无明显现象,加入H2O2酸性溶液 | 溶液变为红色 | X中含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com