
| A. | 足量的溴的四氯化碳溶液 | B. | 与足量的液溴反应 | ||
| C. | 点燃 | D. | 在一定条件下与氢气加成 |
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:填空题
| 实验装置 | 电解质溶液 | 实验现象 | |
 | 5mol/L NaCl溶液 | a极附近 | b极附近 |
| 开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
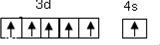 .
.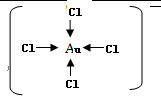 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与浓硝酸、浓硫酸混合反应制TNT (取代反应) | |
| B. | 苯与乙烯在催化剂存在下反应制取乙苯 (取代反应) | |
| C. | 甲苯与酸性KMnO4溶液反应 (氧化反应) | |
| D. | 甲苯制取甲基环已烷 (加成反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷没有同分异构体 | |
| B. | CH(CH3)2CH2CH2CH3的一氯代物有4种 | |
| C. | 二氯苯有3种,则四氯苯有6种 | |
| D. | CH3OH与CH2OH-CH2OH都属于醇,互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质与水反应都能生成碱和H2 | |
| B. | 碱金属单质都是质软、电和热的良导体,焰色反应都呈现黄色 | |
| C. | 碱金属的密度都小于1g/cm3,因此碱金属单质都可以保存在煤油中 | |
| D. | 碱金属单质在空气中燃烧都生成过氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
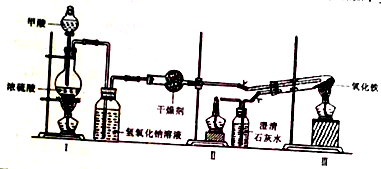
| 加热方式 | 产物元素组成 | 各元素的质量分数/% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在医疗上碳酸钠、Al(OH)3均可用于治疗胃酸过多 | |
| B. | 人造刚玉的熔点很高,可用作高级耐火材料,其主要成分是SiO2 | |
| C. | 水玻璃可用于生产粘合剂和防火剂 | |
| D. | 自来水中加入少量明矾,水解生成Al(OH)3胶体可以起到杀菌消毒的作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com