
| A. | 氢气在氯气中燃烧 | B. | 钠在氯气中燃烧 | ||
| C. | 氢气在氧气中燃烧 | D. | 细铁丝在氯气中燃烧 |
分析 A、氢气在氯气中燃烧产生苍白色火焰;
B、钠在氯气中燃烧产生白色烟;
C、氢气在氧气中燃烧发出淡蓝色火焰;
D、细铁丝在氯气中燃烧发出棕黄色烟;
解答 解:A、氢气在氯气中燃烧产生苍白色火焰,是特征现象,反应生成氯化氢气体,H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,故A不符合;
B、钠在氯气中燃烧生成白色烟,生成白色固体氯化钠固体小颗粒,2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl,故B符合;
C、氢气在氧气中燃烧产生淡蓝色火焰,生成水,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,故C不符合;
D、细铁丝在氯气中燃烧生成棕黄色烟,是生成的氯化铁固体小颗粒,3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4,故D不符合;
故选B.
点评 本题考查了氯气性质分析,反应现象的理解应用,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:解答题
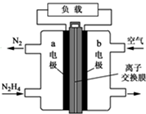 肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景.其工作原理如上图所示,回答下列问题:
肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景.其工作原理如上图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉、氯化钾、硫酸钡 | B. | 氯水、次氯酸钠、乙醇 | ||
| C. | 液氯、胆矾、干冰 | D. | 重水、烧碱、水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| Al2O3 | Si | Na2O2 | 水泥、玻璃、陶瓷 |
| 两性氧化物 | 单质 | 碱性氧化物 | 无机非金属材料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应:CH3COO-+H2O?CH3COOH+OH-,使得溶液中的c(OH-)>c(H+) | |
| B. | 在常温下,10 mL 0.2 mol•L-1盐酸与10 mL 0.2 mol•L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=13 | |
| C. | 在0.1 mol•L-1 NH4Cl溶液中:c(H+)+c(NH4+=c(Cl-) | |
| D. | 5 mL 1 mol•L-1 CH3COONa溶液与5 mL 1 mol•L-1盐酸混合液中c(Cl-)=c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直接露天焚烧秸秆 | B. | ?风能发电 | ||
| C. | 汽车直接排放尾气 | D. | 用石油作燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
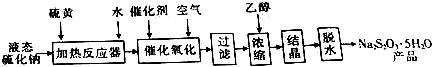
| 溶液温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 氧化完全所需时间/h | 6 | 5.5 | 5.5 | 6 | 20 | 16 | 11 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{2}^{3}$He原子核内有2个中子 | |
| B. | ${\;}_{2}^{3}$He原子核外有3个电子 | |
| C. | ${\;}_{2}^{3}$He原子核内有3个质子 | |
| D. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同的核素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com