
已知A、B、C、D、E、F、G、H可以发生如图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。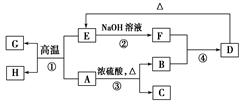
请完成以下填空:
(1)H的名称是________。
(2)E的两种用途是________、________。
(3)反应③的化学方程式是________。
(4)反应④的离子方程式是________。
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:填空题
某含氯化合物A由两种短周期元素组成,常温下该物质为气态,测得该气体对空气的相对密度为3.0,A溶于水可得只含单一溶质B的弱酸性溶液,B溶液在放置过程中其酸性会增强。常温下,气体A与NH3反应生成离子晶体C、气体单质D和常见液体E,D为空气中含量最多的物质。气体A可用某一气体单质与潮湿的Na2CO3反应制得,同时生成两种钠盐。请回答下列问题:
(1)气体A的化学式为 ,气体单质D对应元素在周期表中的位置为 。
(2)用化学方程式表示B溶液酸性增强的原因 。
(3)气体A与NH3反应的化学方程式为 ,该反应体现气体A具有 性。
(4)试写出制取气体A的化学方程式为 。
(5)设计实验探究离子晶体C的成分为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某同学对Cl2与KI溶液的反应进行了实验探究。反应装置如下:
通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为无色。继续通入氯气,最后溶液变为浅黄绿色。
(1)已知I2+I- I3- ,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
I3- ,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
| | 操作 | 实验现象 |
| a | 取2~3 mL黄色溶液,加入足量CCl4, 振荡静置。 | CCl4层呈紫红色, 水层显浅黄色。 |
| b | 取2~3 mL饱和碘水,加入足量CCl4, 振荡静置。 | CCl4层呈紫红色,水层几近无色。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某研究性学习小组设计两套实验方案制备氨气并探究其还原性(部分夹持装置已省略)。
甲方案:如图所示。
乙方案:如图所示。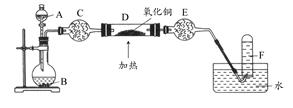
根据方案回答下列问题:
(一)甲方案
(1)B装置盛装碱石灰,A装置中药品可以是 。
a.氯化铵固体和烧碱 b.碳酸氢铵固体
c.氯化铵固体 d.硫酸铵和熟石灰
(2)实验完毕后,设计简单实验检验D试管收集到的物质(简述操作过程、现象和结论) 。
(3)写出C中发生反应的化学方程式 。
(二)乙方案
(4)A为浓氨水,B为生石灰,简述实验原理: 。E装置里盛装的药品是 。
(5)能证明氨气具有还原性的实验现象 。(任写两条)
(6)铜有+2价、+1价、0价,根据氧化还原反应原理,D玻璃管里还原产物除铜外,还可能有 ,假设有铜以外的还原产物生成,写出D中发生反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
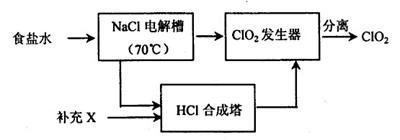
组同学发现84消毒液与洁厕剂(主要成分为盐酸)室温下混和有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2。
(1)若用次氯酸钙、浓盐酸为原料,利用下图装置制取Cl2。装置中仪器a的名称为 。甲同学想证明Cl2溶于水有酸性物质生成,将发生装置产生的气体直接通入适量水中,并加入NaHCO3粉末,有无色气泡产生。乙同学认为不合理,理由是 。又知:室温下H2CO3的电离常数K1=4.2×10-7,K2=5.6×10-11,则pH为8.0的NaHCO3溶液中[CO32-]:[HCO3-]= 。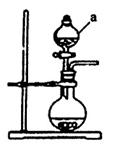
(2)经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。设计如下装置制备无水FeCl3。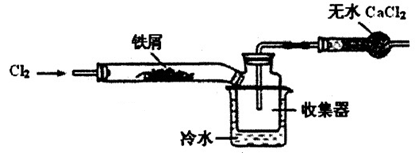
①下列操作步骤的正确排序为 (填字母)。
| A.体系冷却后,停止通入Cl2 |
| B.通入干燥的Cl2赶尽装置中的空气 |
| C.在铁屑下方加热至反应完成 |
| D.用干燥的H2赶尽Cl2 |
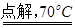 NaClO3+3H2
NaClO3+3H2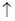 ,
,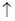 +Cl2
+Cl2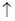 +2NaCl+2H2O。
+2NaCl+2H2O。| 物质 | 熔点/℃ | 沸点/℃ |
| C1O2 | -59 | 11 |
| Cl2 | -107 | -34.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
获取知识和信息是现代人不可缺少的素质,信息产业的飞速发展离不开材料科学的推动。信息产业的核心材料是高纯度的硅,单晶硅可用来制作大规模集成电路、整流器等,硅纯度越高,大规模集成电路的性能就越好。高纯度的单晶硅生产方法有:
方法一:三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
方法二:用金属硅化物(Mg2Si)与盐酸作用制得硅烷,再热分解硅烷可得高纯硅。
根据上述信息回答以下问题:
(1)从方法一生产单晶硅的过程看,由焦炭还原得到的硅为何还要进一步处理?_________________________________________________________。
(2)写出方法二中生产高纯硅的两个化学方程式:
①____________________________________________________________;
②__________________________________________________________。
(3)写出由纯SiHCl3制备高纯硅的化学方程式:____________________________________。
(4)在方法一中,整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是_____________________________________________________。
(5)比较方法一和方法二,分析一下各自的优缺点____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)陶瓷、水泥和玻璃是常用的传统的无机非金属材料,其中生产普通玻璃的主要原料有 。
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
①工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃除生成粗硅外,也可以生产碳化硅,则在电弧炉内可能发生的反应的化学方程式为 。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,粗硅生成SiHCl3的化学反应方程式 。
(3)有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和 ;SiHCl3极易水解,其完全水解的产物为 。
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某试剂厂用银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银。步骤如下
依据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用________硝酸(填“浓”或“稀”)。原因是________ (填序号,下同)
a.减少过程中产生NOx的量
b.减少原料银的消耗量
c.节省硝酸的物质的量
(2)步骤B加热保温的作用是________。
a.有利于加快反应速率
b.有利于未反应的硝酸挥发
c.有利于硝酸充分反应,降低溶液中c(H+)
(3)步骤C中是为了除去Fe3+、Cu2+等杂质,冲稀静置时发生的化学反应是________。
a.置换反应
b.水解反应
c.氧化还原反应
产生的沉淀物化学式________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上利用氨催化氧化后,经过一系列反应可以制备硝酸。
(1)氨气催化氧化的化学方程式为 _
(2)某工厂排出的尾气中NOx的含量为0.56%(体积分数),用氨气可以将其转化为无害气体,发生的反应为:6NOx+4xNH3=(3+2x)N2+6xH2O 若处理1×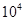 L(标准状况)该尾气需42.5gNH3,则x= _ 。
L(标准状况)该尾气需42.5gNH3,则x= _ 。
(3)NO和CO都是汽车尾气中的有害物质,必须进行处理。为避免污染,常给汽车安装尾气净化装置。净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如图所示。写出净化过程中的总化学反应方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com