
| A. | 我国2015年玉月1日正式实施的《环境保护法》被称为“史上最严”环保法,为保护好环境,工业生产应从源头上减少或尽量消除生产对环境的污染 | |
| B. | 在某爆炸事故救援现场,消防员发现存放金属钠、电石、甲苯二异氰酸酯 等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 | |
| C. | 世界卫生组织认为青蒿素(结构如右图所示)联合疗法是当下治疗疟疾最 有效的手段,已经拯救了上百万生命,靑蒿素属于烃类物质 | |
| D. | 某品牌化妆品在广告中反复强调:“十年专注自然护肤”,该产品中不含任何化学成分 |
分析 A.绿色化学的核心为工业生产应从源头上减少或尽量消除生产对环境的污染;
B.钠燃烧生成过氧化钠,过氧化钠与二氧化碳反应;
C.青蒿素中含O元素;
D.产品中中物质均为化学成分.
解答 解:A.化学原理从源头上减少和消除工业生产对环境的污染,而不能污染后再治理,则符合被称为“史上最严”的新《环境保护法》,故A正确;
B.钠燃烧生成过氧化钠,过氧化钠与二氧化碳反应生成氧气,则钠起火不能用泡沫灭火器将火扑灭,故B错误;
C.青蒿素中含O元素,为烃的含氧衍生物,故C错误;
D.产品中中物质均为化学成分,不存在不含化学成分的物质,故D错误;
故选A.
点评 本题考查有机物的结构和性质,侧重于学生的分析能力的考查,为高考常见题型,注意把握有机物的结构和官能团的性质为解答该类题目的关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 酸 | 电离平衡常数 |
| 醋酸 | Ka=1.75×10-5 |
| 次氯酸 | Ka1=2.98×10-8 |
| 碳酸 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
| 亚硫酸 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
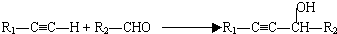 (R代表烃基,下同.)
(R代表烃基,下同.)
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
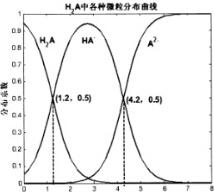 常温下0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分数系数)随pH变化的关系如图所示.下列表述不正确的是( )
常温下0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分数系数)随pH变化的关系如图所示.下列表述不正确的是( )| A. | H2A?2H++A2- K=10-5.4 | |
| B. | 在0.1mo/LNaHA溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 已知25℃时HF的Ka=10-3.45,将少量H2A的溶液加入足量的NaF溶液中,发生的反应为:H2A+F-═HF+HA- | |
| D. | 将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 用pH计测得次氯酸钠溶液的pH>7 | HClO是弱酸 |
| B | 向10mL0.1 mol/L NaOH溶液中加入1mL 0.1mol/LMgCl2溶液,然后再向混合溶液中 滴加CuCl2溶液,产生蓝色沉淀 | 溶度积:Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C | 在淀粉溶液中加入稀硫酸,水浴加热,一段 时间后,滴入几滴碘水,溶液变为蓝色 | 淀粉没有水解 |
| D | 在未知溶液中滴加BaCl2溶液出现白色沉淀, 加稀硝酸,沉淀不溶解 | 该未知溶液中存在SO42-或SO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有前四周期元素A、B、C、D、E,原子序数依次增大.A的基态原子核外电子占据3个能级,最外层电子数是电子层数的2倍.基态B原子与A同周期,p能级达到半充满.C原子电子层数与最外层电子数相等.B和E同主族,基态D原子的价层电子排布通式为ns2np1.
现有前四周期元素A、B、C、D、E,原子序数依次增大.A的基态原子核外电子占据3个能级,最外层电子数是电子层数的2倍.基态B原子与A同周期,p能级达到半充满.C原子电子层数与最外层电子数相等.B和E同主族,基态D原子的价层电子排布通式为ns2np1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17g羟基和17gOH-含有的电子数均为10NA | |
| B. | 2L0.5 mol•L-1醋酸溶液中含有的H+数为NA | |
| C. | 标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体体积为22.4L | |
| D. | 7.8gNa2O2与足量的CO2和H2O(g)混合气体充分反应,转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.铝热反应 | B.燃料燃烧 | C.酸碱中和反应 | D.Ba(OH)2•8H2O与NH4Cl固体混合 |
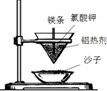 |  | 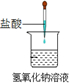 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com