
| A、在蒸馏的实验中,温度计的水银球位于支管口处是为了测出馏分的沸点 |
| B、可用四氯化碳萃取溴水中的溴 |
| C、在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失 |
| D、作为重结晶实验的溶剂,杂质在此溶剂中的溶解度受温度影响应该很大 |


科目:高中化学 来源: 题型:
| A | 宇宙中含量最高的元素 |
| B | 2P轨道有一对成对电子 |
| C | 第一电离能比左右相邻元素小 |
| D | 单质为黄色固体,是古代黑火药的主要成分之一 |
| E | 位于周期表的第11列 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+ |
| B、Al3+ |
| C、Cu2+ |
| D、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓盐酸 | MnO2 | NaBr | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
| C | 浓硫酸 | Na2SO4 | FeCl3溶液 | SO2具有还原性 | |
| D | 稀盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可以用酒精萃取出碘单质 |
| B、可以用CCl4萃取出碘单质,理由是CCl4密度比水大 |
| C、若用CCl4萃取出碘单质,萃取后下层液体呈紫红色 |
| D、若用CCl4萃取出碘单质,萃取后无色液体层应从分液漏斗的上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol水的摩尔质量是36g?mol-1 | ||
B、一个钠原子的实际质量约等于
| ||
| C、1.5mol O2的体积约为33.6L | ||
| D、将 100mL水加入到 100mL 1mol/L的NaOH溶液中,所得溶液为0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
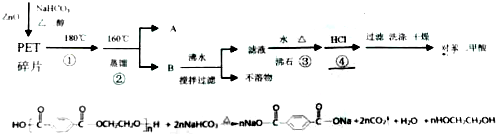
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com