
| 实验组号 | ① | ② | ③ | ④ |
| 碳化物(g) | 7.8 | 15.6 | 23.4 | 31.2 |
| 水(mL) | 18 | 18 | a | a |
| 气体(L/标况) | 2.8 | 5.6 | 7 | 7 |
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算出乙炔的物质的量,再结合反应方程式CaC2+2H2O=Ca(OH)2+C2H2↑计算出需要CaC2含量为96%的电石的质量;
(2)①根据表中数据可知,①②中碳化物不足,水过量,可设出①中Al4C3、Mg2C3的物质的量,然后分别根据质量和生成气体体积列式计算;
②根据反应Al4C3+12H2O→4Al(OH)3+3CH4↑、Mg2C3+4H2O→2Mg(OH)2+C3H4↑可知,参与反应的水的物质的量是生成气体的物质的量的4倍,据此计算出水的物质的量及质量;
(3)发生反应为:反应Al4C3+12H2O→4Al(OH)3+3CH4↑、CaC2+2H2O=Ca(OH)2+C2H2↑;烧瓶质量减轻了7.4g,减轻的质量为生成气体的质量,根据n=$\frac{V}{{V}_{m}}$计算出生成甲烷和乙炔的总物质的量,然后设甲烷的物质的量为x、乙炔的物质的量为y,分别根据质量和气体的量列式计算出生成甲烷和乙炔的物质的量;再根据n=$\frac{m}{M}$计算出C的物质的量、设出主反应中分解的甲烷为的物质的量,分别根据反应甲烷分解的方程式计算出分解后混合气体中含有乙炔、甲烷和氢气的物质的量,再结合平均分子质量及质量守恒列式计算出主反应中分解的甲烷的物质的量,最后计算出甲烷分解的总物质的量及分解率.
解答 解:(1)标况下10.08L乙炔的物质的量为:$\frac{10.08g}{22.4L/mol}$=0.45mol,设需要CaC2含量为96%的电石的质量为xg,根据反应CaC2+2H2O=Ca(OH)2+C2H2↑可知,$\frac{96%x}{64}$=0.45mol,解得:x=30
答案为:30
2)①根据表中数据可知,①②中随着碳化物质量的增加,生成气体体积增大,③④中生成气体体积相等,而碳化物的质量不同,说明①②中碳化物不足、水过量,而③④中水完全反应,碳化物过量,
设①中Al4C3、Mg2C3的物质的量分别为x、y,根据质量可得:144x+84y=7.8,根据生成气体体积可得:3x+y=$\frac{2.8}{22.4}$=0.125,联立解得:x=0.025mol、y=0.05mol,故混合物中Al4C3与Mg2C3的物质的量之比为:0.025mol:0.05mol=1:2,
故答案为:1:2;
②根据反应Al4C3+12H2O→4Al(OH)3+3CH4↑、Mg2C3+4H2O→2Mg(OH)2+C3H4↑可知,参与反应的水的物质的量是生成气体的物质的量的4倍,③④中水不足,完全反应,则参与反应的水的物质的量为:$\frac{7L}{22.4L/mol}$×4=1.25mol,水的质量为:22.5g,
故答案为:22.5g;
(3)烧瓶质量减轻了7.4g,减轻的质量为生成气体的质量,根据反应Al4C3+12H2O→4Al(OH)3+3CH4↑、CaC2+2H2O=Ca(OH)2+C2H2↑可知,生成气体为乙炔和甲烷,总物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,设甲烷的物质的量为x、乙炔的物质的量为y,则x+y=0.4、16x+26y=7.4g,联立解得:x=0.3mol、y=0.1mol,
0.03gC的物质的量为:$\frac{0.03g}{12g/mol}$=0.0025mol,根据副反应CH4→C(s)+2H2可知,反应分解的甲烷的物质的量为0.0025mol,生成氢气的物质的量为:0.0025mol×2=0.005mol,
设主反应2CH4→C2H2+3H2中甲烷分解的物质的量为xmol,则反应生成乙炔的物质的量为0.5xmol,生成氢气的物质的量为1.5xmol,
甲烷分解后的气体中含有乙炔的物质的量为:(0.1+0.5x)mol,甲烷的物质的量为:(0.3-x-0.0025)mol=(0.2975-x)mol,氢气的物质的量为:(0.005+1.5x)mol,分解后气体的质量为:7.4g-0.03g=7.37g,
根据平均分子质量为11,平均摩尔质量为11g/mol,则:11g/mol×(0.1+0.5x+0.2975-x+1.5x+0.005)mol=7.37g,解得:x=0.272mol,
甲烷分解的总物质的量为:0.272mol+0.0025mol=0.2745mol,
所以甲烷的分解率为:$\frac{0.2745mol}{0.3mol}$×100%=91.5%,
答:甲烷的分解率为91.5%.
点评 本题考查了混合物反应的计算,题目难度较大,注意明确讨论法、平均摩尔质量及质量守恒定律在化学计算中的应用,(3)为难点,涉及的计算量较大,充分考查了学生的分析、理解能力.


科目:高中化学 来源: 题型:选择题
| A. | Cl-、Br-、CrO42- | B. | CrO42-、Br-、Cl- | C. | Br-、Cl-、CrO42- | D. | Br-、CrO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/LKMnO4溶液体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | 50 | 10 | t3 |
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同,进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
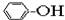 ⑥
⑥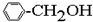 ⑦
⑦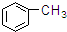 ⑧
⑧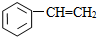
| A. | ①③ | B. | ②④ | C. | ⑤⑥ | D. | ⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
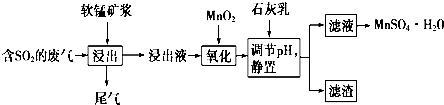
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入过量Cl2,①、②均向右移动,溶液pH减小 | |
| B. | 加入CaCO3悬浊液,CaCO3的溶解平衡向右移动 | |
| C. | 加入澄清石灰水,c(H+)一定减小 | |
| D. | 加入一定量NaOH溶液后,溶液中离子浓度的关系可能为c(Cl-)+c(ClO-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下0.1 mol•L-1的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,c(N${{H}_{4}}^{+}$)由大到小的顺序为②>①>③ | |
| B. | 常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(C${{O}_{3}}^{2-}$)+2c(OH-)=c(HC${{O}_{3}}^{-}$)+3c(H2CO3)+2c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中:c(N${{H}_{4}}^{+}$)+c(NH3•H2O)=2c(C2${{O}_{4}}^{2-}$)+2c(HC2${{O}_{4}}^{-}$)+2c(H2C2O4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com