
| A. | ①②④⑤ | B. | ③④ | C. | ③④⑤ | D. | ②③⑤ |
分析 ①用pH计测得溶液pH大于7,说明溶液呈碱性;
②加入盐酸,产生有色刺激性气体,说明溶液中含有NO2-;
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体,说明溶液中含有Cl-、NO2-;
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色,说明溶液含有CO32-,没有SO42-、SO32-;
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN溶液,显红色,说明溶液中含有具有氧化性的离子NO2-、或SO32-.
解答 解:由实验④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色,可知白色沉淀是BaCO3,气体是CO2,所以可以排除SO42-和SO32-;
实验③可以证明含有Cl-,由于要放出有色刺激性气体,所以只能是亚硝酸的自身分解,反应的方程式为:2HNO2═H2O+NO↑+NO2↑所以因此该同学只需要完成③④两个实验,即可得出此结论,选项B正确.
故选B.
点评 本题考查常见阴离子的检验,要掌握常见阴离子的检验方法,并会设计合理的实验的方法.离子性质和离子检验是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 2.00 | |
| ② | 1.00 | ||
| ③ | 2.00 | ||
| ④ | 2.00 |
 (3)整个实验中应控制的不变量是硝酸溶液体积和CaCO3质量.
(3)整个实验中应控制的不变量是硝酸溶液体积和CaCO3质量.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl沉淀生成和溶解同时在不断进行,且速率相等 | |
| B. | AgCl难溶于水,则溶液中没有Ag+和Cl- | |
| C. | 只要向含有AgCl的饱和溶液中加入盐酸,一定会有沉淀生成 | |
| D. | 向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀不变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
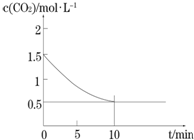 一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.
一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com