
设NA为阿伏加德罗常数,下列说法正确的是
A.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
B.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L
C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA
D.100ml1mol/LAlCl3溶液中含的阳离子数为0.1NA
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源:2016届黑龙江省高三上期末理综化学试卷(解析版) 题型:选择题
下列实验操作与实验目的或结论一致的是
选项 | 实验操作 | 实验目的或结论 |
A | 取酸雨试样,加入10%H2O2溶液,再加入BaCl2溶液,有白色沉淀生成 | 该酸雨试样中一定含有H2SO4 |
B | 将锌片和银片用导线连接后同时插入盛有稀硫酸的烧杯中,银片表面产生大量气泡 | 形成的原电池中锌作负极,银作正极 |
C | 某无色溶液,加银氨溶液,水浴加热,有银镜生成 | 溶液中一定含有醛类化合物 |
D | 配制FeCl2溶液时,先将FeCl2溶于适量稀硝酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的铁粉 | 抑制Fe 2+水解,并防止Fe 2+被氧化为Fe3+ |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上学期12月月考化学试卷(解析版) 题型:选择题
在下列变化中,一定需要另外加入氧化剂才能实现的是
A、HCl→H2 B、Br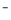 →Br2 C、Fe2O3→Fe D、KMnO4→O2
→Br2 C、Fe2O3→Fe D、KMnO4→O2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上学期12月月考化学试卷(解析版) 题型:推断题
下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。
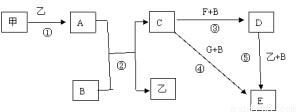
请问答下列问题:
(1)A是____________,G是______________。(填化学式)
(2)反应①-⑤中,属于氧化还原反应的是________________(填序号)。
(3)反应⑤的化学方程式为_________________________。
甲与B反应的离子方程式 ___________________________。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是___________________。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式: ____________________。
(6)已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色。向3.9g A和 100g B混合后的溶液中滴入2滴酚酞试液,溶液变红色,片刻红色褪去。(假设过程中液体体积不变)①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的。
上述观点是否正确 ,请通过计算对比数据加以说明_____________________。
②乙同学认为“红色迅速褪去”是由于A + B = 碱 + H2O2 ,H2O2具有氧化性和漂白性导致的。试设计简单实验证明烧瓶内溶液中含H2O2,简述实验原理 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上学期12月月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数,下列叙述正确的是
A. 64g SO2含有氧原子数为1NA
B. 物质的量浓度为0. 5mol/L Mg Cl2溶液,含有Cl-离子数为1NA
C. 标准状况下,22.4L H2O的分子数为1NA
D. 常温常压下,14g N2含有分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二上学期第一次质检化学试卷(解析版) 题型:选择题
爱迪生电池在充电和放电时发生的反应:Fe+ NiO2+2H2O Fe(OH)2+Ni(OH)2,下列该蓄电池推断不正确的是
Fe(OH)2+Ni(OH)2,下列该蓄电池推断不正确的是
A.放电时,Fe参与负极反应,NiO2参与正极反应
B.充电时,阴极上的电极反应式为:Fe(OH)2 + 2e- = Fe + 2OH-
C.蓄电池的电极必须浸入某种碱性电解质溶液中
D.放电时,电解质溶液中的阴离子向正极方向移动
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二上学期第一次质检化学试卷(解析版) 题型:选择题
右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是

A.硝酸铵 B.生石灰 C.氯化镁 D.食盐
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(实验班)化学试卷(解析版) 题型:填空题
液氨气化后,分解产生的氢气可作为氢氧燃料电池的燃料。氨气分解反应的热化学方程式如下:
2NH3(g)  N2 (g) + 3H2(g) ?H = + a kJ·mol-1
N2 (g) + 3H2(g) ?H = + a kJ·mol-1
请回答下列问题:
(1)已知:2H2 (g) + O2 (g) =2H2O(l) ?H = - b kJ·mol-1
NH3 (g)  NH3(l) ?H = - c kJ·mol-1
NH3(l) ?H = - c kJ·mol-1
则4NH3(l) + 3O2 (g) = 2N2 (g) + 6H2O(l) 的?H = kJ·mol-1。
(2)水能发生电离:2H2O(l)  H3O++OH-,液氨也能发生类似的电离。请写出液氨的电离方程式 。
H3O++OH-,液氨也能发生类似的电离。请写出液氨的电离方程式 。
(3)实验室用Pt电极对液氨进行电解可以得到H2和N2 ,若电解过程中阳极收集得到4.48L气体(标况),则转移的电子的数目是 ,标准状况下阴极得到的气体的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高一上段考化学试卷(解析版) 题型:选择题
下列叙述中正确的是( )
A.摩尔是把物质的质量和微观粒子数联系起来的一个基本物理量
B.1摩尔H2SO4的质量为98g/mol
C.国际上规定,0.012 kg 碳原子所含有的碳原子数目为 1 mol
D.1摩尔氢气分子可以表示为1mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com