
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是 ( )。
A.Na2O2中阴、阳离子的个数比为1∶1
B.Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C.Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等
D.Na2O2的漂白原理与SO2的漂白原理相同
科目:高中化学 来源: 题型:
对于一定条件下的可逆反应
甲:A(g)+B(g)C(g) ΔH<0
乙:A(s)+B(g)C(g) ΔH<0
丙:A(g)+B(g)2C(g) ΔH>0
达到化学平衡后,改变条件,按要求回答下列问题:
(1)升温,平衡移动方向分别为(填“向左”、“向右”或“不移动”)
甲________;乙________;丙________。
此时反应体系的温度均比原来____(填“大”或“小”)
混合气体的平均相对分子质量变化分别为(填“增大”、“减小”或“不变”)
甲________;乙________;丙________。
(2)加压,使体系体积缩小为原来的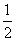
①平衡移动方向(填“向左”、“向右”或“不移动”)
甲________;乙________;丙________。
②设压缩之前压强分别为p甲、p乙、p丙,压缩后压强分别为p、p、p,则p甲与p,p乙与p,p丙与p的关系分别为
甲________;乙________;丙________。
③混合气体的平均相对分子质量变化分别为(填“增大”、“减小”或“不变”)
甲________;乙________;丙________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、C同周期,A、D同主族,A、C常温下能形成两种液态化合物A2C和A2C2,E元素的周期数与主族序数相等。
请用化学用语回答下列问题:
(1)E元素在周期表中的位置为____________,请写出E最高价氧化物对应水化物的电离方程式:_________________________________。
(2)C、D、E三种元素对应简单离子半径从大到小的顺序为_____>_____>_____; 由A、B、C三种元素组成的18电子微粒的分子式为______________________。
(3)用电子式表示BC2的形成过程:_________________________________。
(4)原子序数比C小1的元素F,也能与A形成18电子的分子,已知1 mol该分子在一定条件下可以还原4 mol氧化铜,同时生成一种无污染的气体单质和红色固体还有水。请写出化学方程式:_________________________________。
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式:_________________________________。
(6)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA, DA能与水反应放出氢气,若将1 mol DA和1 mol E单质混合加入足量的水,充分反应后生成的气体在标准状况下的体积是____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下述三个实验均能发生化学反应。
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴浓硝酸 | 将铁钉放入氯化铁溶液中 |
下列判断正确的是 ( )。
A.实验①和③中的铁钉只作还原剂
B.上述实验证明氧化性:Fe3+>Fe2+>Cu2+
C.实验②中Fe2+既显氧化性又显还原性
D.实验③中反应的离子方程式为Fe+Fe3+===2Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O26SO2+Fe3O4,有3 mol FeS2参加反应,转移________mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为________________________________________________________________________;
从腐蚀废液回收得到金属铜,还需要的试剂是________。
 (3)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是________________________________________________________________________。
(3)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是________________________________________________________________________。
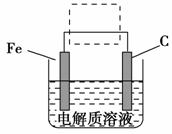
(4)钢铁的电化腐蚀原理如图所示,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在图中虚线框内作出修改,并用箭头标出电子流动方向。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示的是向Na2CO3溶液中滴入稀盐酸时产生CO2
的过程。
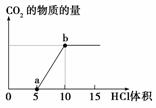
(1)写出a点以前发生反应的离子方程式:_____________________________________
________________________________________________________________________。
(2)写出a到b点发生反应的离子方程式:_____________________________________
______________________________________________________________________。
(3)若某Na2CO3溶液中含m mol Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO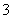 的物质的量浓度之比为2∶1,则滴入的稀盐酸中的HCl的物质的量等于________mol(用含字母m的代数式表示)。
的物质的量浓度之比为2∶1,则滴入的稀盐酸中的HCl的物质的量等于________mol(用含字母m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
1判断正误,正确的划“√”,错误的划“×”
(1)CH3COOH溶液加水稀释后,溶液中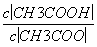 的值减小( )
的值减小( )
(2013·江苏,11C)
(2)室温下,对于0.10 mol·L-1的氨水,加水稀释后,溶液中c(NH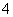 )·c(OH-)变大( )
)·c(OH-)变大( )
(2013·福建理综,8B)
(3)25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH( )
(2013·重庆理综,2B)
(4)稀醋酸加水稀释,醋酸的电离程度增大,溶液的pH减小( )
(2012·重庆理综,10B)
(5)中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等( )
(2012·福建理综,10C)
查看答案和解析>>
科目:高中化学 来源: 题型:
有关溶液中所含离子的检验,下列判断中正确的是( )
A.加入硝酸酸化,再滴加KSCN溶液后有红色物质生成,则原溶液中一定有Fe3+存在
B.加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO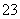 存在
存在
C.用某溶液做焰色反应实验时火焰为黄色,则该溶液中一定有钠元素,可能有钾元素
D.分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐酸盐溶液,只用NaOH溶液是不能一次鉴别开的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com