
【题目】氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)NaClO中Cl的化合价为__________,有较强的_________(填氧化、还原)性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_________。
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为_____________________。
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为_________________。
(3)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。在图示的转化中,化合价不变的元素是__________。该图示的总反应为_______
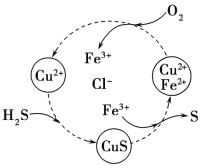
【答案】+1 氧化 Cl2+2OH—=Cl—+ClO—+H2O 2ClO3—+SO2=ClO2+SO42— 2:5 Cu、H、Cl 2H2S+O2=2S↓+2H2O
【解析】
(1)NaClO中Na元素是+1价,O元素是-2价,结合正负化合价的代数和计算Cl元素的化合价;氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(2)①KClO3与SO2在强酸性溶液中反应可制得ClO2,同时应生成硫酸钾;
②可从电子得失守恒的角度计算,也可通过离子方程式计算;
(3)结合图示分析元素化合价的变化,并判断反应物和生成物,再结合守恒法写出总反应方程式。
(1)NaClO中Na元素是+1价,O元素是-2价,有正负化合价的代数和可知Cl元素的化合价为+1价,次氯酸钠具有强氧化性,有杀菌消毒的作用;氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-=ClO-+Cl-+H2O;
(2)①KClO3与SO2在强酸性溶液中反应可制得ClO2,同时应生成硫酸钾,反应的离子方程式为2ClO3-+SO2=2ClO2+SO42-;
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,反应中ClO2为氧化剂,Cl元素化合价由+4价降低为-1价,Mn2+为还原剂,元素化合价由+2价升高到+4价,氧化剂和还原剂得失电子数目相等,则氧化剂和还原剂的物质的量之比为2:5;
(3)据图中各元素化合价知,Cu元素化合价都是+2价、H元素化合价都是+1价、Cl元素化合价都是-1价,所以化合价不变的是Cu、H、Cl元素;图示反应物为H2S和O2,生成物为S和H2O,Fe2+和Cu2+起催化作用,发生的总反应为2H2S+O2![]() 2S↓+2H2O。
2S↓+2H2O。


科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应2SO2+O2![]() 2SO3,反应达平衡的标志是
2SO3,反应达平衡的标志是
①单位时间内消耗2 mol SO2的同时生成2 mol SO3
②反应混合物中,SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A. ①②B. ①③C. ①D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiOH常用于制备锂离子电池正极材料。工业上常利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法正确的是

A. a是电源的负极
B. A电极的电极反应式为4OH--4e-===2H2O+O2↑
C. B极区电解液为LiOH溶液
D. 外电路中每通过0.1 mol电子,生成1.12 L氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池在我们的生活中有着重要的应用,请回答下列问题:
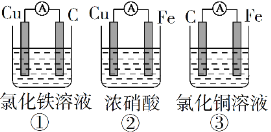
(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应式_______。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________。
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
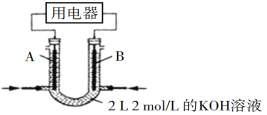
实验测得OH定问移向B电极,则_____(填“A”或“B”)处电极入口通甲烷,其电极反应式为___________。当消耗甲院的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠加热后能在空气中着火燃烧的现象是
A. 黄色火焰,生成白色固体Na2O
B. 黄色火焰,生成淡黄色固体Na2O2
C. 紫色火焰,生成淡黄色固体Na2O2
D. 红色火焰,生成黄色固体Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应中,氧化反应与还原反应在同种元素中进行的是
A.Cl2+2NaOH===NaCl+NaClO+H2O
B.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
C.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为气体化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。若甲为淡黄色固体,D和A的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。

则(1)A的分子式是______________,甲的电子式是______________。
(2)D的溶液与乙反应的离子方程式是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com