
分析 (1)需要0.1mol/L的NaOH溶液480mL,应选择500mL容量瓶,实际配制500mL溶液,依据m=CVM计算需要溶质的质量;
(2)依据配制溶液的一般步骤选择需要的玻璃仪器,确定缺少的玻璃仪器;
(3)容量瓶带有活塞,使用前应先检查是否漏水;
(4)依据配制溶液的一般步骤排序;
(5)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(6)计算氢氧化钠和氢氧化钙中含有氢氧根离子总的物质的量,依据C=$\frac{n}{V}$计算混合后溶液中氢氧根离子浓度.
解答 解:(1)需要0.1mol/L的NaOH溶液480mL,应选择500mL容量瓶,实际配制500mL溶液,需要氢氧化钠的质量m=0.1mol/L×40g/mol×0.5L=2.0g;
故答案为:2.0;
(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,所以需要的玻璃仪器为:①烧杯 ④500mL容量瓶 ⑤玻璃棒;还缺少的仪器:胶头滴管;
故答案为:①④⑤,胶头滴管;
(3)容量瓶带有活塞,使用前应先检查是否漏水;
故答案为:检漏;
(4)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,所以正确的顺序为:⑤②①③④;
故答案为:⑤②①③④;
(5)①未洗涤烧杯、玻璃棒,导致溶质的物质的量偏小,溶液浓度偏低,故不选;
②称量NaOH的时间太长,氢氧化钠吸收空气中水和二氧化碳,导致称取的氢氧化钠的物质的量偏小,溶液浓度偏低,故不选;
③定容时俯视刻度,导致溶液体积偏小,溶液浓度偏高,故选;
④NaOH溶液未冷却至室温就转移到容量瓶中,冷却后溶液体积偏小,溶液的物质的量浓度偏高,故选;
故选:③④;
(6)200mL0.01mol/LNaOH与50mL0.02mol/LCa(OH)2溶液混合所含的氢氧根离子物质的量n=0.2L×0.01mol/L+0.02mol/L×2×0.05L=0.004mol,则混合后溶液中氢氧根离子物质的量浓度C=$\frac{0.004mol}{0.25L}$=0.016mol/L;
故答案为:0.016.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制过程及有关物质的量浓度计算是解题关键,注意误差分析的方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用无水酒精萃取碘水中的碘 | |
| B. | Na2O2粉末加人到FeSO4溶液中.产生白色沉淀,并放出大量气泡 | |
| C. | 将浓氨水滴加到碱石灰中可制得氨气,也可用碱石灰干燥氨气 | |
| D. | 往酸性KMnO4溶液中通人SO2验证SO2的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
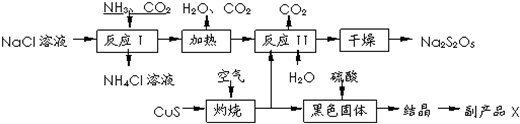
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
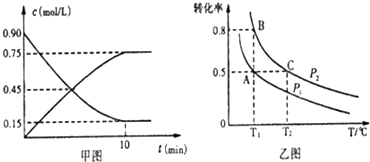 硫及其化合物有广泛应用.
硫及其化合物有广泛应用.| NH3•H2O | H2SO3 | ||
| 电离平衡常数为 (mol•L-1) | 1.7×10-5 | Ka1 | Ka2 |
| 1.54×10-2 | 1.02×10-7 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
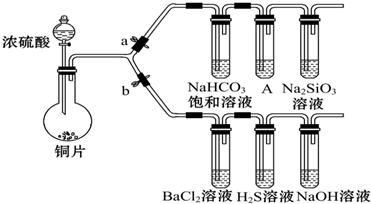
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
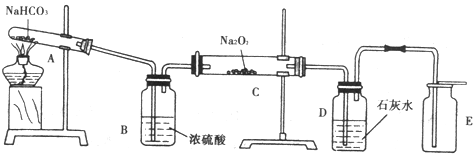
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒压下充入稀有气体 | B. | 减小反应容器的体积 | ||
| C. | 升高反应温度 | D. | 分离出生成物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com