
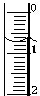
 某化学兴趣小组使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
某化学兴趣小组使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
分析 (1)溶液的稀释在烧杯中进行,溶液的定容在对应体积的容量瓶中进行;
(2)根据准确量取酸溶液应通过酸式滴定管来量取;强碱滴定弱酸时应选择碱性变色范围内的指示剂酚酞;
(3)根据碱溶液应盛放在碱式滴定管中;根据滴定管的结构与精确度来分析;
(4)滴定终点时溶液由无色恰好变为红色,并在半分钟内不褪色;
(5)根据数据的合理性来分析,然后求出平均消耗的NaOH溶液的体积,然后根据关系式:CH3COOOH~NaOH来解答.
解答 解:(1)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液,
故答案为:100mL容量瓶;
(2)准确量白醋溶液应通过酸式滴定管来量取;食醋与NaOH反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂酚酞,
故答案为:酸式滴定管;酚酞;
(3)NaOH 溶液应盛放在碱式滴定管中;滴定管液面的读数0.70mL;
故答案为:碱式滴定管;0.70;
(4)NaOH滴定食醋的终点为:溶液由无色恰好变为红色,并在半分钟内不褪色,
故答案为:溶液由无色恰好变为红色,且半分钟内不褪色;
(5)第1次滴定误差明显大,应舍去;3次消耗的NaOH溶液的体积分别为:15.00mL、15.05mL、14.95mL,则NaOH溶液的体积的平均值为15.00mL;
设10mL市售白醋样品含有 CH3COOOH Xg,则
CH3COOOH~NaOH
60 40
Xg×0.2 0.1000mol/L×0.015L×40g/mol
X=0.450
样品总酸量$\frac{0.450g}{0.01L}$=4.500g/100mL,
故答案为:4.500.
点评 本题以测定市售白醋的总酸量考查了中和滴定操作以及化学计算,难度不大,注意实验原理的掌握.


科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:选择题
在常温下,0.10mol·L-1Na2CO3溶液25mL 用0.10mol·L-1盐酸滴定,其滴定曲线如图。对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
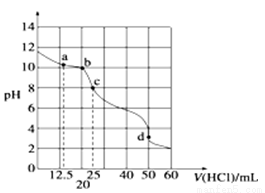
A.a点:c(CO2-3)=c(HCO-3)>c(OH-)
B.b点:5c(Cl-)>4c(HCO-3)+4c(CO2-3)
C.c点:c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3)
D.d点:c(H+)=c(CO2-3)+c(HCO-3)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.向含有 CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1∶2
C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
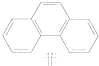
| A. | 丙烷的一氯代物有2种,丙烷的二氯代物有4种 | |
| B. | 分子式为C8H10,且属于芳香族化合物的同分异构体只有3种 | |
| C. | 菲的结构简式如右图,它与硝酸反应,所得一硝基取代物有5种 | |
| D. | 甲苯苯环上的一个氢原子被一C3H7取代,所得有机产物有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 朴硝和消石加强热都不分解 | |
| B. | 朴硝和消石都属于强电解质 | |
| C. | 朴硝和消石都既含有离子键又含有共价键 | |
| D. | “紫青烟起”是由于消石中的K+在火焰上灼烧时呈现出特殊颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 有机化合物 | 同分异构体数目 |
| A | 分子式为C8H10的芳香烃 | 3种 |
| B | 分子式为C4H8的烯烃 | 2种 |
| C | 分子式为C6H12O2的羧酸 | 8种 |
| D | 分子式为C4H10O的醇 | 5种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com