
A、氨的电子式为: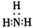 | ||||
B、含78个中子的碘的放射性核素:
| ||||
C、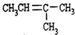 的名称:2-甲基-2-丁烯 的名称:2-甲基-2-丁烯 | ||||
D、纯碱溶液呈碱性的原理:CO
|
科目:高中化学 来源: 题型:





查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E | F | G |
| 化合价 | -2 | -1 | -2、+6 | +4、-4 | +3 | +1 | +4、-4 |
| 原子半径(nm) | 0.074 | 0.099 | 0.102 | 0.117 | 0.143 | 0.186 | 0.077 |
查看答案和解析>>
科目:高中化学 来源:2011--2012学年四川省成都二十中高二上学期期中考试化学试卷 题型:填空题
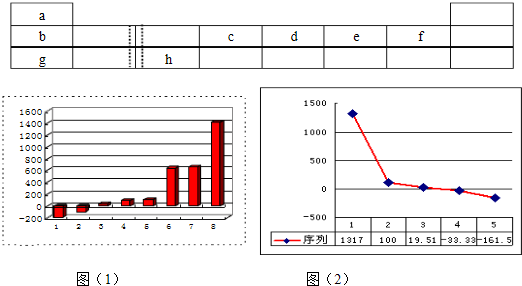
(8分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语或符号回答下列问题:
| a | | | | | | | |
| b | | | c | d | e | f | |
| g | | h | | | | | |


查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省南阳市高三上学期期末质量评估化学试卷(解析版) 题型:填空题
(11分)几种短周期元素的原子半径及主要化合价见下表:

分析上表的有关数据,并结合已学过知识,请用化学用语到答下列问题。
(1)写出D元素在周期表中的位置___________________。
(2)含20克F的最高价氧化物的水化物的稀溶液与足量B的氢化物的稀溶液反应放出热量a kJ,请写出该反应的热化学反应方程式____________________________。
(3)用电子式表示F2C2的形成过程______________________________。
(4)BA2能与盐酸反应得到黄绿色气体,试写出化学反应方程式:__________________,
B、C、F的最高价氧化物对应的水化物形成溶液,浓度均为0.1mol/L时,pH由大到小的顺序为___________________。
(5)lmol F2A2与水反应生成的溶液与lL 0.5mol/LEB3溶液反应的离子方程式为
______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com