
| Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | |
| 开始沉淀的pH | 10.4 | 1.9 | 7.0 |
| 沉淀完全的pH | 12.4 | 3.2 | 9.0 |
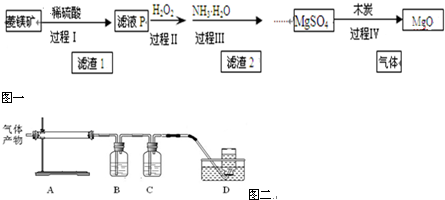
分析 以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁,菱镁矿加稀硫酸溶解后过滤得到滤液主要为MgSO4、FeSO4和过量的硫酸,过程Ⅱ滤液中加入过氧化氢氧化亚铁离子为铁离子,加入一水合氨调节溶液PH使铁离子全部沉淀,过滤得到滤液为硫酸镁溶液,加入木炭800℃煅烧MgSO4反应生成氧化镁和硫单质和一氧化碳气体;
(1)依据上述分析可知菱镁矿加稀硫酸溶解后过滤得到滤液主要为MgSO4、FeSO4和过量的硫酸,依据溶液组成分析含有的阳离子;
(2)过程Ⅱ滤液中加入过氧化氢发生氧化还原反应,氧化亚铁离子为铁离子;
(3)依据铁离子和镁离子沉淀PH,过程Ⅲ中加入NH3•H2O调节溶液pH约为4,使铁离子全部沉淀,镁离子不沉淀;
(4)煅烧得到的气体主要有SO2、CO2、CO、S,产生的气体进行分步吸收或收集,所以通过A使硫蒸气冷凝下来,再通过B装置高锰酸钾溶液吸收二氧化硫,通过C中的氢氧化钠溶液吸收二氧化碳,最后剩余一氧化碳气体在D中收集.
解答 解:以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁,菱镁矿加稀硫酸溶解后过滤得到滤液主要为MgSO4、FeSO4和过量的硫酸,过程Ⅱ滤液中加入过氧化氢氧化亚铁离子为铁离子,加入一水合氨调节溶液PH使铁离子全部沉淀,过滤得到滤液为硫酸镁溶液,加入木炭800℃煅烧MgSO4反应生成氧化镁和硫单质和一氧化碳气体;
(1)由分析可知菱镁矿加稀硫酸溶解后过滤得到滤液主要为MgSO4、FeSO4和过量的硫酸,依据溶液组成分析含有的阳离子为H+、Fe2+、Mg2+,
故答案为:H+、Fe2+、Mg2+;
(2)过程Ⅱ滤液中加入过氧化氢发生氧化还原反应,氧化亚铁离子为铁离子,过程Ⅱ中发生的氧化还原反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)依据铁离子和镁离子沉淀PH,过程Ⅲ中加入NH3•H2O调节溶液pH约为4,其目的是使铁离子全部沉淀,镁离子不沉淀,
故答案为:使Fe3+沉淀完全而Mg2+不沉淀;
(4)煅烧得到的气体主要有SO2、CO2、CO、S,产生的气体进行分步吸收或收集,所以通过A使硫蒸气冷凝下来,再通过B装置高锰酸钾溶液吸收二氧化硫,通过C中的氢氧化钠溶液吸收二氧化碳,最后剩余一氧化碳气体在D中收集;
①A中试管壁附着有淡黄色固体为S,故答案为:S;
②a、氢氧化钠溶液能吸收二氧化碳和二氧化硫,不能确定气体成分,故a错误;
b、二氧化硫气体、二氧化碳气体都和碳酸钠反应,且二氧化硫反应能生成二氧化碳,不能确定生成气体成分,故b错误;
c、稀硝酸氧化二氧化硫气体,本身被还原为一氧化氮气体,干扰气体检验,故c错误;
d、B中盛放的溶液可以利用KMnO4溶液吸收二氧化硫,故d正确,
故答案为:d;
③800℃煅烧MgSO4,产生气体产物是S和CO的化学方程式为MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑,故答案为:MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑.
点评 本题考查了物质提纯和分离的实验过程分析和性质应用,混合物分离方法和实验操作方法,物质性质熟练掌握是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题

 CH3COOCH2CH2OOCCH3+2H2O.
CH3COOCH2CH2OOCCH3+2H2O.
 、
、 ;.
;.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (3m+n)mol | B. | ($\frac{5m}{2}$+$\frac{n}{2}$-3p)mol | C. | ($\frac{5m}{2}$+$\frac{n}{2}$)mol | D. | (3m+n+2p)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中KNO3是氧化剂,N2是还原产物 | |
| B. | 每生成16 mol N2转移30 mol电子 | |
| C. | 若氧化产物比还原产物多1.75mol,则转移电子的物质的量为1.25mol | |
| D. | 该反应中氧化产物与还原产物的质量之比为1:15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都等于零 | B. | SO2、O2、SO3的浓度相等 | ||
| C. | SO2、O2、SO3在容器中共存 | D. | SO2、O2、SO3的浓度均不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com