
| A. | 碘单质升华,克服的是其分子间作用力 | |
| B. | 金刚石、石墨、纳米碳管是碳元素的同素异形体 | |
| C. | 目前科学家还无法实现对原子或分子的操纵 | |
| D. | HCl气体溶于水后,共价键被破坏,从而形成了H+和Cl- |
分析 A、分子间作用力决定分子晶体的物理性质;
B、同种元素形成的不同种单质叫同素异形体;
C、科学家已经实现对单个原子或分子的操纵;
D、HCl气体溶于水后,因为共价键被破坏.
解答 解:A、分子间作用力决定分子晶体的物理性质,所以碘单质升华,克服的是碘分子间作用力,故A正确;
B、金刚石、石墨、纳米碳管都是碳元素形成的单质,是碳元素的同素异形体,故B正确;
C、科学技术的发展,使人们操纵单个原子和分子成为可能,目前,科学家已经实现对单个原子或分子的操纵,故C错误;
D、HCl气体溶于水后,因为共价键被破坏,所以HCl气体溶于水后,共价键被破坏,从而形成了H+和Cl-,故D正确.
故选C.
点评 本题考查了化学键的破坏和化学键的类型,碘是分子晶体破坏分子间作用力,氯化氢是共价化合物溶于水破坏共价键,为易错点.


科目:高中化学 来源: 题型:解答题
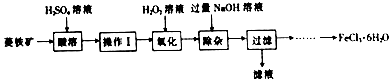
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、I-、K+、Br2 | B. | Mg2+、Cu2+、SO42-、NO3- | ||
| C. | Fe2+、Cl2、K+、SO42- | D. | ClO-、Cl-、CO2、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解为乙烯属于取代反应 | |
| B. | 乙酸分子中含有碳氧双键,所以它能使溴水褪色 | |
| C. | 蛋白质在一定条件下发生水解反应生成葡萄糖 | |
| D. | C4H10进行一氯取代后生成四种沸点不同的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 元素的相关信息 |
| M | 最高价氧化物对应的水化物能与其气态氢化物反应生成盐 |
| N | 原子的M电子层上有3个电子 |
| W | 在短周期元素中,其原子半径最大 |
| X | 其最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成X的单质和H2O |
| Y | 元素最高价正价与最低负价的代数和为6 |
| A. | M的气态氢化物具有还原性,常温下,该氢化物水溶液的pH>7 | |
| B. | W单质在氧气中燃烧后的产物中阴阳离子个数之比为1:2 | |
| C. | 由N和Y所形成的化合物中存在离子键,属于离子化合物 | |
| D. | N、W、X的最高价氧化物对应的水化物两两之间能相互发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
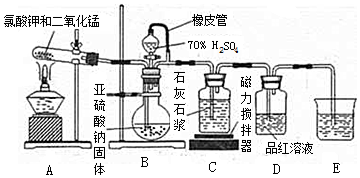
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | dacb | B. | bcad | C. | acbd | D. | dcba |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com