
【题目】某学习小组为验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,设计如图装置进行实验(夹持仪器已略去)。(查阅资料):NO与NaOH溶液不反应,NO2与NaOH溶液能反应(反应的化学方程式为2NO2+2NaOHNaNO3+NaNO2+H2O)。
备选药品:浓硝酸、3mol·L-1稀硝酸、蒸馏水、浓硫酸、NaOH溶液及CO2气体。回答下列问题。

(1)连接好装置,滴加浓硝酸之前的操作依次是:____________,加入药品,打开装置①中的弹簧夹后通入CO2一段时间,关闭弹簧夹,将装置④中导管末端伸入倒置的烧瓶内。通入CO2的目的是____________。
(2)若用质量分数为70%浓硝酸(密度为1.42g·cm-3)配制250mL3mol·L-1的稀硝酸,除量筒、烧杯、胶头滴管外,还要用到的玻璃仪器有____________、____________。
(3)装置①中发生反应的化学方程式为____________。
(4)装置①中产生的气体通过盛有水的洗气瓶时发生反应的化学方程式为____________。
(5)根据实验设计,装置②中盛放的试剂是____________。
(6)做实验时应避免有害气体排放到空气中,装置⑤中盛放的药品是____________。
(7)验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO的实验现象是____________。
【答案】检查装置的气密性 排出装置内残留的空气(或:防止装置内残留空气中的O2将NO氧化) 250mL容量瓶 玻璃棒 Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O 3NO2+H2O2HNO3+NO 3mol·L-1稀硝酸 氢氧化钠溶液 装置②中液面上方气体仍为无色,装置③中液面上方气体由无色变为红棕色
【解析】
①装置是浓硝酸与铜片反应制取NO2,然后与水反应,将NO2转化为NO。②装置与③装置是用来验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,所以②装置盛有稀硝酸,若液面上方气体仍为无色,则证明稀硝酸不能氧化NO,④用来处理NO尾气; ③装置盛有浓硝酸,若液面上方气体由无色变为红棕色,则证明浓硝酸能将NO氧化成NO2,⑤装置盛有氢氧化钠溶液,用来处理尾气NO2。
(1)制取气体的装置在使用之前要先检查装置的气密性。因为NO易被空气氧化,所以在牵涉到物质能与装置中的空气反应时,一定要先排出装置内残留的空气。
(2)配制一定物质的量浓度的溶液时,需要用到的玻璃仪器有量筒、烧杯、胶头滴管、一定规格的容量瓶、玻璃棒。
(3) ①装置是浓硝酸与铜片反应制取NO2,所以其反应为Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O。
(4) ①装置生成了NO2,然后NO2与水反应。
(5) 由分析可知②装置与③装置是用来验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,所以②装置盛有稀硝酸
(6)由分析可知③装置盛有稀硝酸,若液面上方气体由无色变为红棕色,则证明浓硝酸能将NO氧化成NO2,⑤装置盛有氢氧化钠溶液,用来处理尾气NO2。
(7) ②装置盛有稀硝酸,若液面上方气体仍为无色,则证明稀硝酸不能氧化NO;③装置盛有浓硝酸,若液面上方气体由无色变为红棕色,则证明浓硝酸能将NO氧化成NO2。


科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如表:
元素编号 | 元素性质或原子结构 |
T | M层上有6个电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
W | 其单质既能跟酸反应,又能跟强碱反应,都产生H2 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是_____。
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式_____,如何检验某溶液中含该离子_____。
(3)元素Z在周期表中的位置_____,元素Z与元素T相比,非金属性较强的是_____(用元素符号表示),下列表述中能证明这一事实的是_____(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下,Z和T的单质都能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(每空1分)Ⅰ.根据结构对有机物进行分类,有助于对其性质的掌握。
(1)下列有机物属于芳香烃的是____________ (填字母),它与苯的关系是____________,写出苯与溴发生反应的化学方程式 ___________________________________,
预测该芳香烃____________ (填“能”或“不能”)发生该类反应。
A. B.
B. C.
C.
(2)下列有机物属于羧酸类的是_________ (填字母)。
a.CH3CHO b.![]() c.
c. 
(3)下列有机物属于糖类的是_________ (填字母)。
A.油脂 B.纤维素 C.蛋白质
Ⅱ.下列几组物质中,互为同位素的有____________,互为同素异形体的有___________,互为同系物的有____________,互为同分异构体的有____________,属于同种物质的有____________。
①O2和O3 ②35Cl和37Cl
③![]() 和
和![]() ④
④ 和
和
⑤CH3(CH2)2CH3和(CH3)2CHCH3 ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。FeSO47H2O广泛用于医药和工业领域,以下是测定某补血剂(有效成分为FeSO47H2O)中铁元素含量的流程图。根据题意完成下列填空:

(1)人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。补血剂与维生素C一起服用,有利于+2价铁的吸收。由此可推知,维生素C具有____________(填“氧化性”或“还原性”)。
(2)步骤Ⅱ需要100mL1mol·L-1的稀硫酸,实验室用质量分数为98%的浓硫酸(密度为1.84g·cm-3)来配制,需用量筒量取浓硫酸____________mL。
(3)步骤Ⅲ所得滤液中滴加KSCN溶液后滤液变为红色,则滤液中含有____________(填离子符号)。检验滤液中还存在Fe2+,应选用的试剂为____________(填字母)
A.NaCl溶液B.酸性KMnO4溶液C.NaOH溶液
(4)步骤Ⅳ加入过量H2O2的目的是____________(用离子方程式表示)。
(5)步骤Ⅵ的一系列操作依次是:①过滤②洗涤③____________④冷却⑤称量⑥恒重操作,操作⑥的目的是____________。
(6)假设实验无损耗,则每片补血剂含铁元素的质量为____________g(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有HA、HB和H2C三种酸。室温下用0.1mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH 溶液体积的变化如图所示。

(1)a点时的溶液中由水电离出的c(H+)=________mol·L-1,Ka(HB)=________。
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为________;b点对应的溶液中c(HB)____c(B-)(填“>”“<”或“=”)。
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C的一级电离为H2C=H++ HC-,常温下0.1mol·L-1H2C溶液中的c(H+ )=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
(4)已知温度时,0.1 mol·L-1的某一元酸HB在水中有 0.1% 发生电离,回答下列各问题:
①该溶液的pH=________。
②HB的电离平衡常数K=________。
③由HB电离出的c(H+)约为水电离出的c(H+)的________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的情况。
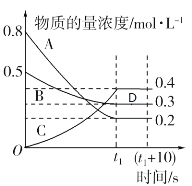
试回答下列问题:
(1)该反应的化学方程式为________。
(2)0~t1s内气体B的平均反应速率为________。
(3)(t1+10)s时,B的物质的量分数为______,此时v正(A)_____v逆(B)(填“>”“<”或“=”),D点是否处于平衡状态_________(填“是”或“否”)。
(4)下列关于该反应的说法正确的是________ (填序号)。
a.到达t1时刻该反应已停止
b.在t1时刻之前,气体B的消耗速率大于它的生成速率
c.在t1时刻,气体C的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,化学性质最不活泼的是__________。
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是__________。
(3)10种元素中最高价氧化物的水化物,酸性最强的是__________。
(4)元素⑦组成的含非极性键的分子的电子式:__________。
(5)区分①、②的碳酸正盐的简单实验方法__________。
(6)①和⑤最高价氧化物对应的水化物相互反应的离子方程式为__________。
(7)③的单质与⑥的最高价氧化物反应的方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验。 请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是________ (填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定——取一定量的草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,表格中记录了实验数据:
滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.00 |
第三次 | 25.00 | 4.00 | 24.10 |
①滴定时发生的离子反应方程式___________,KMnO4溶液应装在______________ (填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是_________________________________。
②该草酸溶液的物质的量浓度为_____________。
(3)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是______(填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com