
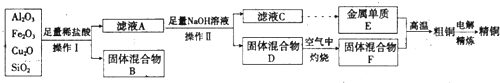
分析 蒸馏与液体混合物的沸点有关;分离固液混合物有过滤、蒸发,而分离两种溶解度相差很大的固体溶质的溶液时,利用结晶法;除去气体中的杂质,利用洗气法;分离两种不互溶的液体混合物,分层选择分液法;粗盐提纯需要溶解、过滤、蒸发操作,以此来解答.
解答 解:分离沸点不同但又互溶的液体混合物,常用的方法是蒸馏.分离固液混合物的常用的方法是过滤、蒸发.分离两种溶解度相差很大的固体溶质的溶液时,常用的方法是结晶法.除去气体中杂质气体的方法是洗气.分离两种不互溶的液体混合物,常用的方法是分液,进行该操作的主要仪器是分液漏斗,使用该仪器前应先查漏.粗盐提纯的步骤是溶解、过滤、蒸发.三步中都使用了玻璃棒,其作用依次是搅拌、引流、搅拌,
故答案为:蒸馏;过滤、蒸发;结晶法;洗气;分液;分液漏斗;查漏;溶解;过滤;蒸发;搅拌;引流;搅拌.
点评 本题考查混合物分离提纯方法,为高频考点,把握物质的性质、常见混合物分离提纯方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,该分子的核磁共振氢谱有2种峰.
,该分子的核磁共振氢谱有2种峰.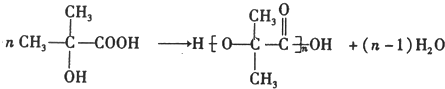 .F→G的反应:(CH3)2C(OH)-CHO+2Cu(OH)2$\stackrel{△}{→}$(CH3)2C(OH)-COOH+Cu2O↓+2H2O.
.F→G的反应:(CH3)2C(OH)-CHO+2Cu(OH)2$\stackrel{△}{→}$(CH3)2C(OH)-COOH+Cu2O↓+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:5 | B. | 1:1 | C. | 2:1 | D. | 5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是( )
如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是( )| A. | 过氧化钠 | B. | 氧化钠 | C. | 钠 | D. | 钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{28m}{n}$ | B. | $\frac{14m}{n}$ | C. | $\frac{n}{28m}$ | D. | $\frac{n}{14m}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com