
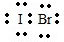 ,由I-Br极性共价键形成的结构不对称分子,为极性分子,
,由I-Br极性共价键形成的结构不对称分子,为极性分子,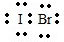 ;极性;极性;
;极性;极性; ,中心原子O有2对孤对电子,成键数为2,则它的VSEPR模型是四面体,由于2对孤电子对的影响,分子构型为V型,
,中心原子O有2对孤对电子,成键数为2,则它的VSEPR模型是四面体,由于2对孤电子对的影响,分子构型为V型, ;四面体;V型.
;四面体;V型.


科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 常见元素A、B、C、D,其原子结构的相关信息如下表:
常见元素A、B、C、D,其原子结构的相关信息如下表:| 元素 | 相关信息 |
| A | 核外电子总数等于该基态原子电子层数 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 基态原子L电子层中有3个未成对电子 |
| D | 生活中大量使用的合金制品,工业上可用电解其氧化物的方法制取其单质 |
| E | 外围电子排布为(n+1)d3n(n+2)sn |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)肼(N2H4)-空气燃料电池是一种新型环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时:
(1)肼(N2H4)-空气燃料电池是一种新型环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、CH3CH3 |
| B、CH3COOH |
| C、CH3CHO |
| D、CH3CH2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com