
【题目】硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应方程式如下:Na2SO4+4C →Na2S+ 4CO,Na2SO4+4CO→Na2S+4CO2
(1)现有无水芒硝17.75g,若生成过程中无水芒硝的利用率为80%,则理论上可得到Na2S_____g,最多生成标况下的CO_____L。
(2)若在反应过程中生成的Na2S3mol,则消耗的碳单质的物质的量 n的范围是____mol≤n≤___mol,若生成等物质的量CO和CO2,则消耗的碳的物质的量为____mol。
(3)Na2S放置在空气中,会被缓慢氧化成Na2SO4及 Na2SO3,现称取已经部分氧化的硫化钠样品78.40g溶于水中,加入足量盐酸,充分反应后过滤得沉淀19.20g,放出H2S气体2.24L(标准状况)。请计算:78.40g样品中各氧化产物的物质的量(写出必要的计算过程)。_____
【答案】7.8g 8.96L 6mol≤n≤12mol 8 Na2SO3有0.2mol Na2SO40.1mol
【解析】
(1)无水芒硝17.75g 的物质的量=17.75g÷142g· mol-1=0.125mol,若生成过程中无水芒硝的利用率为80%,根据硫元素守恒可以知道,则理论上可得到Na2S的质量是0.125mol![]() =7.8g,根据反应方程式: Na2SO4+4C=Na2S+4CO
=7.8g,根据反应方程式: Na2SO4+4C=Na2S+4CO![]() ,最多生成一氧化碳物质的量是0.125mol
,最多生成一氧化碳物质的量是0.125mol![]() 4=0.4mol,体积是8.96L,因此,本题正确答案是:7.8;8.96;
4=0.4mol,体积是8.96L,因此,本题正确答案是:7.8;8.96;
(2)若生成的气体为CO,消耗的碳的物质的量最多,由Na2SO4+4C=Na2S+4CO![]() 可以知道,生成3molNa2S需要碳的物质的量为3mol
可以知道,生成3molNa2S需要碳的物质的量为3mol![]() 4=12mol ,若生成的气体为CO2,反应方程式为Na2SO4+2C=Na2S+4CO2
4=12mol ,若生成的气体为CO2,反应方程式为Na2SO4+2C=Na2S+4CO2![]() ,消耗的碳的物质的量最少,根据电子转移守恒可知消耗碳为3mol
,消耗的碳的物质的量最少,根据电子转移守恒可知消耗碳为3mol![]() 2=6mol,生成3molNa2S需要碳的物质的量为6mol ,故消耗的碳单质的物质的量n的范围是6mol
2=6mol,生成3molNa2S需要碳的物质的量为6mol ,故消耗的碳单质的物质的量n的范围是6mol![]() n
n![]() 12mol;
12mol;
若生成等物质的量CO和CO2,令各自物质的量为ymol,根据电子注意守恒,则2y+4y=3![]() [6-(-2)],计算得出y=4,根据碳原子守恒可以知道,需要碳的物质的量为4m0l+4mol=8mol,
[6-(-2)],计算得出y=4,根据碳原子守恒可以知道,需要碳的物质的量为4m0l+4mol=8mol,
因此,本题正确答案是: 6mol![]() n
n![]() 12mol;8;
12mol;8;
(3)由硫化钠和盐酸生成氯化钠,单质硫和水,其反应方程式为:2Na2S+ Na2SO3+6HCl= 6NaCl+3S![]() +3H2O,所以沉淀为S,其质量为19.20g,物质的量为0.6mol,由方程式可以知道,参加该反应的Na2S为0.6mol
+3H2O,所以沉淀为S,其质量为19.20g,物质的量为0.6mol,由方程式可以知道,参加该反应的Na2S为0.6mol![]() =0.4mol, Na2SO3的物质的量为0.6mol
=0.4mol, Na2SO3的物质的量为0.6mol![]() =0.2mol, 2.24LH2S气体的物质的量为0.1mol,根据反应2HCl+Na2S = 2NaCl+ H2S
=0.2mol, 2.24LH2S气体的物质的量为0.1mol,根据反应2HCl+Na2S = 2NaCl+ H2S![]() 可以知道,参加该反应的Na2S的物质的量为0.1mol,故样品中Na2SO4的质量为78.40g-0.2mol
可以知道,参加该反应的Na2S的物质的量为0.1mol,故样品中Na2SO4的质量为78.40g-0.2mol![]() 126g/mol-(0.4mol+0.1mol)
126g/mol-(0.4mol+0.1mol)![]() 78g/mol=14.2g,故Na2SO4的物质的量为14.2g÷142g·mol-1=0.1mol,故78.40g样品中氧化产物:Na2SO3为0.2mol, Na2SO4为0.1mol。
78g/mol=14.2g,故Na2SO4的物质的量为14.2g÷142g·mol-1=0.1mol,故78.40g样品中氧化产物:Na2SO3为0.2mol, Na2SO4为0.1mol。
答案:Na2SO3有0.2mol,Na2SO40.1mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某探究小组采用下图所示装置进行Fe粉与水蒸气的反应。

(1)实验前检查装置气密性的方法为______________。
(2)检验实验中生成气体的实验操作是 _____________。
(3)写出试管中发生的化学反应方程式________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示是A、B、C、D、E四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为88的E |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式:_______________。
(2)B具有的性质是________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
(3)B在加热时,能与混酸(浓硫酸和浓硝酸的混合溶液)反应,其化学方程式为___________。
(4)D的结构简式是____________。
(5)如图所示,该实验装置可用于C和D反应制取E。
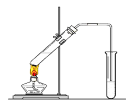
试回答下列问题:
①在右试管中通常加入__________溶液,其作用为___________;
②实验生成E的反应方程式为____________,分离右试管中所得E的操作为__________(填操作名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解是一种非常强有力的促进氧化还原反应的手段,许多很难进行的氧化还原反应,都可以通过电解来实现。
(1)工业上常以石墨做电极,电解NaCl水溶液时,阴极区产物有____,其溶液可用于吸收工业尾气中的SO2,写出反应的化学方程式_____。
(2)电解NaCl水溶液时,用盐酸控制阳极区溶液的pH在2~3,用平衡移动原理解释盐酸的作用_____。离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上发生电镀,有铝产生。
(3)铝原子的核外电子排布式是____,其中有____种不同能级的电子。
(4)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当所得还原产物为6g时,转移电子的物质的量为___mol。
(5)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有____(填编号)。
a.KClO3 b.Mg c.MnO2 d.KCl
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,不能说明固体混合物中无Fe2O3,理由是________(用离子方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:
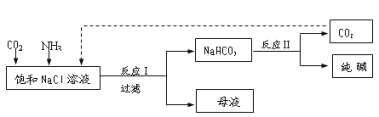
已知NaHCO3在低温下溶解度较小。
(1)反应Ⅰ的化学方程式为______。
(2)处理母液的两种方法:
①向母液中加入石灰乳,反应的化学方程式为____,目的是使____循环利用。
②向母液中____并降温,可得到NH4Cl晶体。
Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。
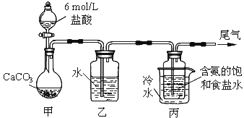
(3)装置丙中冷水的作用是______;由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有______、洗涤、灼烧。
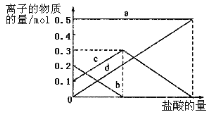
(4)若灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。
取加热了t1min的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。曲线c对应的溶液中的离子是____(填离子符号);该样品中NaHCO3和Na2CO3的物质的量分别是___mol、___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A |
| 装置气密性良好 |
B | 将氧化铁加入到足量的HI溶液中,充分溶解后,滴加四氯化碳,震荡静置,下层呈紫红色。 | I2氧化性强与Fe3+ |
C | 往氢氧化铜沉淀中分别滴加盐酸和氨水,沉淀皆溶解 | 氢氧化铜为两性氢氧化物 |
D | 将SO2通入Na2CO3溶液中生成的气体,通入澄清石灰水中有浑浊 | 说明酸性:H2SO3﹥H2CO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列 离子组在对应的溶液中一定能大量共存的是
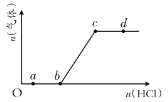
A.a点对应的溶液中:Fe3+、AlO2-、SO42-、NO3-
B.b 点对应的溶液中:K+、Ca2+、I-、Cl-
C.c 点对应的溶液中:Na+、Ca2+、NO3-、Ag+
D.d 点对应的溶液中:F-、NO3-、Fe2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 0.3mol·L-1 Na2SO4溶液和50mL 0.2mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为(假设混合前后溶液体积变化忽略不计)( )
A.0.20mol·L-1B.0.25mol·L-1C.0.40mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) △H=+Q kJ/mol(Q>0),等温、恒压条件下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
Si(s)+4HCl(g) △H=+Q kJ/mol(Q>0),等温、恒压条件下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
A.反应过程中,若充入与反应无关的气体,由于保持压强不变,则反应速率不变
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为Q kJ
C.当反应吸收热量为0.025Q kJ时,生成的HCl通入100mL1mol/L的NaOH溶液恰好完全反应
D.反应至4min时,若HCl浓度为0.12mol/L,则0~4min内H2的反应速率为0.03moL/(Lmin)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com