
| A. | HCl和MgCl2 | B. | H2O和CO2 | C. | NH4Cl和CCl4 | D. | HCl和NaOH |
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 维生素C和食盐都是强电解质 | |
| B. | 维生素C和食盐都是供能物质 | |
| C. | 维生素C具有还原性,在空气中易被氧化 | |
| D. | 等物质的量的维生素C和食盐溶于水,其溶质质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
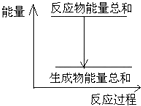
| A. | 反应过程中能量关系如图所示,则该反应为放热反应 | |
| B. | 化学反应的反应热与反应方程式的计量数有关 | |
| C. | 若将该反应设计成原电池,锌为负极 | |
| D. | 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ | |
| B. | SO2通入BaCl2溶液中:Ba2++SO2+H2O=BaSO3↓+2H+ | |
| C. | 硫酸铵溶液与Ba(OH)2溶液反应:Ba2++SO42-=BaSO4↓ | |
| D. | FeCl2溶液与Cl2反应:2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 硫酸工业生产中用水吸收SO3 | SO3可与水反应 | Ⅰ对,Ⅱ对,有 |
| B | 铝材可用作装修材料 | 金属铝的导电性好 | Ⅰ对,Ⅱ对,无 |
| C | 向锅炉中加入Na2CO3溶液有利于除去锅炉中的硫酸钙 | 硫酸钙比碳酸钙更难溶 | Ⅰ错,Ⅱ错,无 |
| D | 氮化硅可用于制造高温陶瓷 | 氮化硅的硬度大且熔点高 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离常数 (25℃) | Ki=1.77×10-4 | Kii=2.98×10-6 | K1Ki1=4.3×10-7 Ki2=5.6×10-11 | Ki1=1.54×10-2 Ki2=5.6×10-7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com