
【题目】芳香族有机物A(C11H12O2)可用作果味香精,用含碳、氢、氧三种元素的有机物B和C为原料可合成A.请按所给信息及相关要求填空:
(1)有机物B的蒸气密度是同温同压下氢气密度的23倍,分子中碳、氢原子个数比为1:3.有机物B的分子式为 .
(2)有机物C的分子式为C7H8O,C能与钠反应,不与碱反应,也不能使溴的四氯化碳溶液褪色.C的名称为
(3)已知两个醛分子间能发生如下反应(R、R′表示氢原子或烃基): ![]() 用B和C为原料按如下路线合成A:
用B和C为原料按如下路线合成A:
①上述合成过程中涉及的反应类型有:(填写序号)
a.取代反应 b.加成反应 c.消去反应 d.氧化反应 e.还原反应
②F的结构简式为: .
③G和B反应生成A的化学方程式: .
(4)F的同分异构体有 多种,写出既能发生银镜反应又能发生水解反应,且苯环上只有一个取代基的所有同分异构体的结构简式 .
【答案】
(1)C2H6O
(2)苯甲醇
(3)abcd;![]() ;
;![]()
(4)![]()

【解析】解:(1)B的蒸气密度是同温同压下氢气密度的23倍,则Mr(B)=23×2=46,分子中碳、氢原子个数比为1:3,设B的分子式为(CH3)xOy , 则15x+16y=46,可得x=2,y=1,故B的分子式为C2H6O, 所以答案是:C2H6O;(2)C的分子式为C7H8O,不饱和度为4,不能使Br2的CCl4溶液褪色,应含有苯环,C能与钠反应,不与碱反应,结合C能发生催化氧化,含有醇羟基,故C的结构简式为 ![]() ,其名称为苯甲醇,
,其名称为苯甲醇,
所以答案是:苯甲醇;(3)B的分子式为C2H6O,能发生催化氧化生成D,则B为CH3CH2OH,D为CH3CHO,C发生催化氧化生成E为 ![]() ,D与F发生信息中醛的加成反应生成F,则F为
,D与F发生信息中醛的加成反应生成F,则F为 ![]() ,F发生消去反应生成H为
,F发生消去反应生成H为 ![]() ,H发生氧化反应生成G为
,H发生氧化反应生成G为 ![]() ,G与乙醇发生酯化反应生成A为
,G与乙醇发生酯化反应生成A为 ![]() ;①上述合成过程中,依次发生氧化反应、加成反应、消去反应、氧化反应、取代反应,没有发生还原反应,故选:abcd;②由上述分析可知,F的结构简式为:
;①上述合成过程中,依次发生氧化反应、加成反应、消去反应、氧化反应、取代反应,没有发生还原反应,故选:abcd;②由上述分析可知,F的结构简式为: ![]() ,所以答案是:
,所以答案是: ![]() ;③G和B反应生成A的化学方程式为:
;③G和B反应生成A的化学方程式为: ![]() ,
,
所以答案是: ![]() ;(4)F(
;(4)F( ![]() )同分异构体有多种,其中既能发生银镜反应又能发生水解反应,说明含有甲酸形成的酯基,且苯环上只有一个取代基,符合条件的所有同分异构体的结构简式为:
)同分异构体有多种,其中既能发生银镜反应又能发生水解反应,说明含有甲酸形成的酯基,且苯环上只有一个取代基,符合条件的所有同分异构体的结构简式为: ![]()
 ,所以答案是:
,所以答案是: ![]()
 .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某周期ⅡA族元素的原子序数为 x,则同周期的第ⅢA族元素的原子序数是( )
A.只有 x+1
B.可能是 x+8或 x+18
C.可能是 x+2
D.可能是 x+1或 x+11或x+25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漆酚 ![]() 是生漆的主要成分,黄色,能溶于有机溶剂.生漆涂在物体表面能在空气中干燥而转变为黑色漆膜.下列关于漆酚说法错误的是( )
是生漆的主要成分,黄色,能溶于有机溶剂.生漆涂在物体表面能在空气中干燥而转变为黑色漆膜.下列关于漆酚说法错误的是( )
A.可以燃烧,当氧气充分时,产物为CO2和H2O
B.与FeCl3溶液发生显色反应
C.能发生取代反应和加成反应
D.不能被酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下列装置模拟工业生产制备少量硝酸。

(1)装置 A 的作用是________, NaOH 溶液的作用是 _________________________。
(2)化学实验室制氨气化学方程式为__________。
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到 700℃以上。下列图示中,能够正确表示该反应过程能量变化的是(填字母)_____________。

(4)在微电子工业中,氨气的水溶液可作刻蚀剂 H2O2 的清除剂,所得产物不污染环境,其化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
A. ![]() N2H4(g)+
N2H4(g)+![]() O2(g) ===
O2(g) ===![]() N2(g)+H2O(g)ΔH=+267 kJ·mol-1
N2(g)+H2O(g)ΔH=+267 kJ·mol-1
B. N2H4(g)+O2(g) === N2(g)+2H2O(l)ΔH=-133.5 kJ·mol-1
C. N2H4(g)+O2(g) === N2(g)+2H2O(g)ΔH=+534 kJ·mol-1
D. N2H4(g)+O2(g) === N2(g)+2H2O(g)ΔH=-534 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的密闭容器中发生反应2SO2 + O2 ![]() 2SO3,下列说法正确的是
2SO3,下列说法正确的是
A. 2 molSO2和1 molO2反应可生成2 molSO3
B. 向上述反应中再加入18O2,达平衡时,18O只存在于SO3中
C. 升高温度,只能加快2SO2+O2![]() 2SO3(g)反应的正反应速率
2SO3(g)反应的正反应速率
D. 选择适宜的催化剂能增大反应速率,提高生产效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应的快慢和限度具有十分重要的意义。
回答下列问题:
(1)反应2SO2(g) + O2(g)![]() 2SO3(g)是制备硫酸的重要反应,该反应为放热反应。降低温度,逆反应的速率_________;使用催化剂V2O5,正反应的速率__________ (以上填“增加”、“不变”或“减小”), 催化剂对该反应的平衡状态_________影响(“有”或“无”)。
2SO3(g)是制备硫酸的重要反应,该反应为放热反应。降低温度,逆反应的速率_________;使用催化剂V2O5,正反应的速率__________ (以上填“增加”、“不变”或“减小”), 催化剂对该反应的平衡状态_________影响(“有”或“无”)。
(2)常温下,实验室用100 mL 6.0 mol·L-1硫酸跟足量锌粉反应制取氢气。
①为降低反应进行的速率,又不影响生成氢气的量,可向反应物中加入____(填序号 )。
A.CH3COONa固体 B.KNO3固体
C.K2SO4溶液 D.KHSO4溶液
②向溶液中滴加少量硫酸铜溶液,反应速率加快,原因是___________________。
(3)一定温度下,在体积固定的密闭容器中,有色气体N与无色气体M的物质的量随时间变化曲线如图所示。图中能够表明起始加入的物质是__________________,反应达平衡的时间是____________,该反应的化学方程式可表示为______________________________;下列说法中能够判定该反应处于平衡状态的是______________填 序号)。

A.容器的压强不再变化
B.气体的颜色不再变化
C.每反应2 mol的N生成1 mol的M
D.气体的密度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4 . 考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用.回答Ⅰ和Ⅱ中的问题.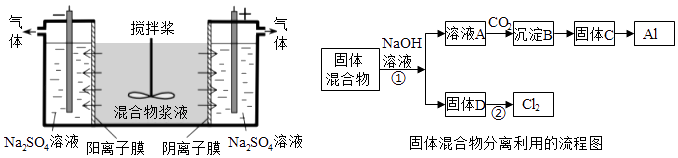
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为 . B→C的反应条件为 , C→Al的制备方法称为 .
(2)该小组探究反应②发生的条件.D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2 . 由此判断影响该反应有效进行的因素有(填序号) .
a.温度 b.Cl﹣的浓度 c.溶液的酸度
(3)0.1mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2xH2O的液态化合物,放热4.28kJ,该反应的热化学方程式为 .
Ⅱ含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42﹣能从浆液中分离出来的原因是 , 分离后含铬元素的粒子是;阴极室生成的物质为(写化学式).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com