
【题目】利用某工业废铁粉(主要成分为Fe2O3.Fe等)与硫酸反应可制备硫酸亚铁。
(1)Fe元素在周期表中的位置是________写出该废铁粉与硫酸主要反应的离子方程式________________。
(2)FeSO4隔绝空气受热分解生成SO2 SO3 Fe2O3。SO2分子的空间构型为________,其中S原子的杂化轨道类型为________。与SO2互为等电子体的离子与分子分别为________,________(填化学式)
(3)苯酚溶液中滴入Fe3+离子,溶液显________色。1mol苯酚中含有σ键的数目为________。
(4)Fe3O4有反尖晶石结构。某化合物MgxAlyOz与反尖晶石结构相仿,其结构如下图所示,它是由下列A.B方块组成。该化合物的化学式为________.

(5)常温条件下,铁的晶体采用如图所示的堆积方式。则这种堆积模型的配位数为________,如果铁的原子半径为0.12nm,阿伏伽德罗常数的值为NA,则此种铁单质的密度表达式为________g/cm3

【答案】 第四周期 第Ⅷ族 Fe+H2SO4==FeSO4+H2↑ Fe2O3+3H2SO4==Fe2(SO4)3+3H2O V形 sp2 NO2- O3 紫色 13mol MgAl2O4 8 
【解析】试题(1)Fe是26号元素,有4个电子层,价电子排布是3d64s2;该废铁粉主要是铁与反应生成硫酸亚铁和氢气、氧化铁与硫酸反应生成硫酸铁和水;SO2分子中S原子价层电子对=3,成键电子对=2,孤电子对=1;等电子体是原子数相同、价电子数相同的微粒;(3)苯酚遇Fe3+离子显紫色;单键都是σ键,双键中有1个σ键;(4)根据均摊原则A中有Mg原子![]() 、O原子数4 ;B中有Mg原子
、O原子数4 ;B中有Mg原子![]() 、O原子数4、Al原子数4;(5)铁原子的堆积方式是体心立方;原子半径为0.12nm,则体对角线是0.48nm,晶体边长=
、O原子数4、Al原子数4;(5)铁原子的堆积方式是体心立方;原子半径为0.12nm,则体对角线是0.48nm,晶体边长=![]() ,一个晶胞含有铁原子数
,一个晶胞含有铁原子数![]() ;
;
解析:Fe是26号元素,有4个电子层,价电子排布是3d64s2,在周期表中的位置是第四周期 第Ⅷ族;铁与反应生成硫酸亚铁和氢气,反应化学方程式是Fe+H2SO4==FeSO4+H2↑;氧化铁与硫酸反应生成硫酸铁和水,方程式是Fe2O3+3H2SO4==Fe2(SO4)3+3H2O;SO2分子中S原子价层电子对=3,成键电子对=2,孤电子对=1,所以SO2分子的空间构型为V形,其中S原子的杂化轨道类型为sp2;等电子体是原子数相同、价电子数相同的微粒,与SO2互为等电子体的离子与分子分别为NO2-、 O3;(3)苯酚溶液中滴入Fe3+离子,溶液显紫色;单键都是σ键,双键中有1个σ键,1mol苯酚中含有σ键的数目为13mol;根据均摊原则A中有Mg原子![]() 、O原子数4 ;B中有Mg原子
、O原子数4 ;B中有Mg原子![]() 、O原子数4、Al原子数4;化合物MgxAlyOz的晶胞中有4个A、4个B,所以Mg原子数
、O原子数4、Al原子数4;化合物MgxAlyOz的晶胞中有4个A、4个B,所以Mg原子数![]() 、O原子数
、O原子数![]() 、Al原子数
、Al原子数![]() ,Mg、Al、O个数比是1:2:4,所以晶胞化学式是MgAl2O4。(5)铁原子的堆积方式是体心立方,所以配位数为8;原子半径为0.12nm,则体对角线是0.48nm,晶体边长=
,Mg、Al、O个数比是1:2:4,所以晶胞化学式是MgAl2O4。(5)铁原子的堆积方式是体心立方,所以配位数为8;原子半径为0.12nm,则体对角线是0.48nm,晶体边长=![]() ,一个晶胞含有铁原子数
,一个晶胞含有铁原子数![]() ;所以铁单质的密度表达式为
;所以铁单质的密度表达式为 g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】对于反应M + N = P,如果温度每升高10℃,化学反应速率增加到3倍,在20℃时完成该反应的30%需要81 min,若将温度升高到40℃,完成该反应的30%需要时间为
A. 9 minB. 27 minC. 13.5 minD. 3 min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:

(1)实验室焙烧海带,需要下列仪器中的_________(填字母)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①________,③________。
(3)提取碘的过程中,可选择的有机试剂是________(填字母)。
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油
(4)小组用CCl4萃取碘水中的碘,在如图的分液漏斗中,下层液体呈________色;打开分液漏斗活塞,却未见液体流下,原因可能是___________________;

(5)实验室制取Fe(OH)3胶体化学反应方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D的原子序数依次增大。甲、乙、丙、丁、戊是由这些元素组成的常见化合物,其中丙、丁、戊为二元化合物,已是元素C的单质。甲、乙的溶液均呈碱性。下列说法错误的是

A. 甲和戊加入水中都能破坏水的电离平衡 B. 乙和戊都含有离子键
C. 原子半径r(D)>r(B)>r(C)>r(A) D. A、B、C形成的化合物一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母 x 等表示),原子半径的相对大小、最高正价或最低负价的变化如下图所示:

根据判断出的元素回答问题:
(1)g 在周期表中的位置是__________.
(2)d、e、h 的简单离子半径由大到小顺序:_____________(用离子符号表示).
(3)有关 y、z、d 三种元素的说法正确的是__________(填序号).
①最高正价:d>z>y ②简单气态氢化物的稳定性:d>z>y
③非金属性:d>z>y ④单质活泼性:y>z>d
(4)根据g 和h 两种元素填空:
①最高正价氧化物对应水化物的酸性由强到弱的顺序是____________.(用化学式表示)
②g2h2 分子中原子都满足 8 电子结构,试写出其电子式____________.
(5)①试写出x、d、e 形成化合物的水溶液与单质f 反应的化学方程式________________.
②已知化合物A、B 均由 x、d、e、g 四种元素组成,试写出A 和B 反应的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持、加热仪器已略去,气密性已检验)。
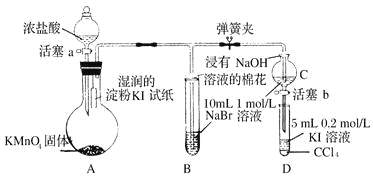
实验过程;
I.打开弹簧夹,打开活塞a,清加浓盐酸。II.当 B 和C 中的溶液都变为黄色时,夹紧弹簧夹。Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。Ⅳ……
(1)A中产生的是黄绿色气体,其离子方程式为____________,在该反应中浓盐酸表现了___________性。
(2)验证氯气的氧化性强于碘的实验现象是___________________________。
(3)B 中溶液发生反应的离子方程式是__________________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是________________________。
(5)过程Ⅲ实验的目的是__________________________。
(6)从元素周期表的递变规律的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示下列描述正确的是

A. 反应开始到10s,用Z表示的反应速率为0.158 mol/(Ls)
B. 反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C. 反应开始到10s,Y的转化率为79.0 %
D. 反应的化学方程式为:X+Y![]() Z
Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol/L NaOH 溶液反应:H+(aq)+OH-(aq)= H2O(l) △H = +57.3 kJ·mol1
B. 已知 2C(s)+O2(g)=2CO(g)△H= -221 kJ·mol-1,则C的燃烧热为△H =- 110.5 kJ·mol1
C. 25℃、30MPa 下,将 0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成NH3(g),放热 19.3kJ, 其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) △H= -38.6kJ·mol1
2NH3(g) △H= -38.6kJ·mol1
D. 密闭容器中,0.3mol 硫粉与 0.2mol 铁粉混合加热生成硫化亚铁 0.2mol 时,放出 19.12 kJ 热量, 则 Fe(s)+S(s)=FeS(s)△H= - 95.6 kJ·mol1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com