
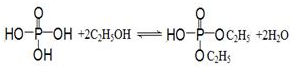 .
.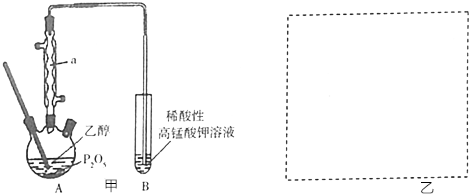
分析 (1)由图可知仪器a为球形冷凝管(或冷凝管),作用是将挥发出的乙醇冷凝回流到烧瓶中,提高反应物利用率;加热液体易发生剧烈沸腾,加沸石可防止暴沸;
(2)乙醇发生消去反应生成乙烯;
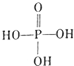
(3)乙醇和磷酸反应生成磷酸二乙酯、水,为酯化反应;
(4)乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化;
(5)在A、B之间增加一个装水的洗气瓶除去乙醇.
解答 解:(1)仪器a的名称为球形冷凝管(或冷凝管),作用是将挥发出的乙醇冷凝回流到烧瓶中,提高反应物利用率;加热液体易发生剧烈沸腾,加沸石可防止暴沸;
故答案为:球形冷凝管(或冷凝管);将挥发出的乙醇冷凝回流到烧瓶中,提高反应物利用率;防止暴沸;
(2)用化学反应方程式表示上述制备乙烯的原理为C2H5OH $→_{P_{2}O_{5}}^{80℃~210℃}$CH2=CH2↑+H2O,
故答案为:C2H5OH $→_{P_{2}O_{5}}^{80℃~210℃}$CH2=CH2↑+H2O;
(3)乙醇和磷酸反应生成磷酸二乙酯、水,为酯化反应,反应为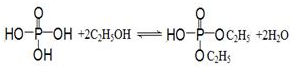 ,
,
故答案为: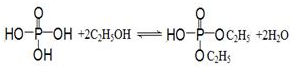 ;
;
(4)用上述装置验证产生了乙烯不够严密,理由是没有排除乙醇的干扰(或在通过酸性高锰酸钾溶液之前,应该除去乙醇),
故答案为:没有排除乙醇的干扰;
(5)用上述装置验证产生了乙烯不够严密,理由是没有排除乙醇的干扰,所以在A、B之间增加一个装水的洗气瓶除去乙醇,装置简图为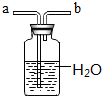 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、有机物的性质、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 方案 | 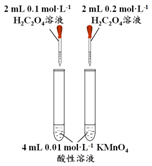 | 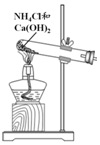 | 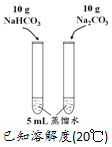 NaHCO3:9.6 g Na2CO3:21.8 g | 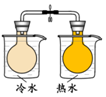 将NO2球浸泡在冷水和热水中 |
| 目的 | 探究浓度对化学反应速率的影响 | 制备氨气 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
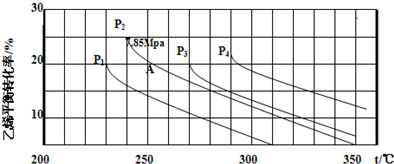
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
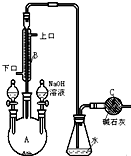 制备溴苯的实验装置如右图所示,请回答下列问题:
制备溴苯的实验装置如右图所示,请回答下列问题: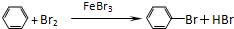 .
. +Br+→[
+Br+→[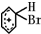 ];[
];[ ]+FeBr4-→
]+FeBr4-→ +HBr+FeBr3.由上述反应可推知:
+HBr+FeBr3.由上述反应可推知: +Br2→
+Br2→ +HBr 中的催化剂为BD.(填字母)
+HBr 中的催化剂为BD.(填字母)查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯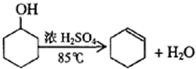
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com