
【题目】据![]() 科技日报
科技日报![]() 报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成含氧化合物。
报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成含氧化合物。
请回答下列问题:
⑴在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”,该原子的外围电子排布式为____________。
⑵在第四周期过渡金属中,基态原子第一电离能最大的元素是___________(填元素符号)。
⑶铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为________________。
⑷常温下,H2O2氧化CH4生成CH3OH、HCHO、 HCOOH等。
①CH3OH、HCHO、 HCOOH的沸点分别为64.7℃、-195℃、100.8℃,其主要原因是____________________;
②CH4和HCHO比较,键角较大的是_________,该分子的空间构型为____________。
⑸配离子中受配体的影响,中心离子同能级d轨道的能量不同,人们把1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量称为d的分裂能,用符号![]() 表示。分裂能大小一般与配体种类和中心离子所带电荷数有关。据此判断分裂能Δ[Co(H2O)6]2+________Δ[Co(H2O)6]3+(填“>”“<”或“=”
表示。分裂能大小一般与配体种类和中心离子所带电荷数有关。据此判断分裂能Δ[Co(H2O)6]2+________Δ[Co(H2O)6]3+(填“>”“<”或“=”![]() ,理由是____________。
,理由是____________。
⑹钴晶胞和白铜(铜镍合金)晶胞如图所示。
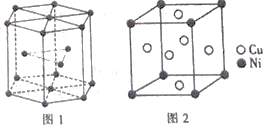
①钴晶胞堆积方式的名称为____________;
②已知白铜晶胞的密度为dgcm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为____________pm(列出计算式)。
【答案】3d104s1 Zn 光谱分析 HCOOH、CH3OH存在氢键,且HCOOH中氢键更强,HCHO分子间存在范德华力 HCHO 平面三角形 < 二者配体相同,但是前者中心离子所带正电荷比后者少,其对电子的吸引力小 六方最密堆积 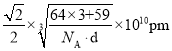
【解析】
⑴具有全充满、半充满、全空的电子构型的原子更稳定,先写出Mn、Fe、Co、Ni、Cu的外围电子排布式,得出结论。
⑵在第四周期过渡金属中,从左到右,第一电离能逐渐增大。
⑶用原子光谱上的特征谱线来鉴定元素称为光谱分析。
⑷①HCOOH、CH3OH存在氢键,且HCOOH中氢键更强,HCHO分子间存在范德华力,氢键比范德华力更强;②CH4中C原子采取sp3杂化,为正四面体构型,HCHO中C原子采取sp2杂化,为平面三角形,HCHO中键角较大。
⑸Δ[Co(H2O)6]2+带2个单位正电荷,而Δ[Co(H2O)6]3+带3个单位正电荷,后者对电离吸引力更大。
⑹①由图1所示,可知钴晶胞的堆积方式是六方最密堆积;②面心6个Cu原子构成正八面体,棱上2个Cu原子与体心连线形成等腰直角三角形,该等腰直角三角形的斜边长即为两个面心上铜原子最短核间距,由几何知识可知两个面心上铜原子最短核间距![]() 直角边长度的
直角边长度的![]() 倍,而等腰直角三角形的直角边长等于晶胞棱长的
倍,而等腰直角三角形的直角边长等于晶胞棱长的![]() ,再求铜、镍数目,求出棱长,再求两个面心上铜原子最短核间距。
,再求铜、镍数目,求出棱长,再求两个面心上铜原子最短核间距。
⑴具有全充满、半充满、全空的电子构型的原子更稳定,在Mn、Fe、Co、Ni、Cu的外围电子排布式分别为3d54s2、3d64s2、3d74s2、3d84s2、3d104s1,Cu原子核外电子排布遵循“洪特规则特例”;故答案为:3d104s1。
⑵在第四周期过渡金属中,基态原子第一电离能最大的元素是Zn;故答案为:Zn。
⑶用原子光谱上的特征谱线来鉴定元素称为光谱分析;故答案为:光谱分析。
⑷①HCOOH、CH3OH存在氢键,且HCOOH中氢键更强,HCHO分子间存在范德华力,氢键比范德华力更强,故沸点HCOOH > CH3OH > HCHO;故答案为:HCOOH、CH3OH存在氢键,且HCOOH中氢键更强,HCHO分子间存在范德华力。
②CH4中C原子采取sp3杂化,为正四面体构型,HCHO中C原子采取sp2杂化,为平面三角形,HCHO中键角较大;故答案为:HCHO;平面三角形。
⑸Δ[Co(H2O)6]2+带2个单位正电荷,而Δ[Co(H2O)6]3+带3个单位正电荷,后者对电离吸引力更大,故分裂能Δ[Co(H2O)6]2+ < Δ[Co(H2O)6]3+;故答案为:<;二者配体相同,但是前者中心离子所带正电荷比后者少,其对电子的吸引力小。
⑹①由图1所示,可知钴晶胞的堆积方式是六方最密堆积;故答案为:六方最密堆积。
②面心6个Cu原子构成正八面体,棱上2个Cu原子与体心连线形成等腰直角三角形,该等腰直角三角形的斜边长即为两个面心上铜原子最短核间距,由几何知识可知两个面心上铜原子最短核间距![]() 直角边长度的
直角边长度的![]() 倍,而等腰直角三角形的直角边长等于晶胞棱长的
倍,而等腰直角三角形的直角边长等于晶胞棱长的![]() 。晶胞中Cu =
。晶胞中Cu = ![]() 、Ni原子数目=
、Ni原子数目= ![]() ,晶胞质量=
,晶胞质量=![]() ,设晶胞棱长为a pm,则:
,设晶胞棱长为a pm,则:![]() ,解得
,解得 ,故两个面心上铜原子最短核间距=
,故两个面心上铜原子最短核间距=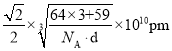 ;故答案为:
;故答案为: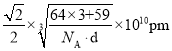 。
。


科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) 4NO2(g)+ O2(g) △H >0, T1温度下的部分实验数据为
t/s | 0 | 500 | 1000 | 1500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A.500s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的平衡常数为K1=125,1000s时N2O5转化率为50%
C.T1温度下的平衡常数为K1 ,T2温度下的平衡常数为K2,若K1<K2,则T1 >T2
D.平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再平衡时c(N2O5) >5.00mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.0.1mol·L-1 AlC13溶液中:H+、Na+、Cl-、SO![]()
B.含有0.1mol·L-1 Fe3+的溶液中:Na+、K+、SCN-、NO![]()
C.使甲基橙变红色的溶液中:Fe2+、K+、NO![]() 、SO
、SO![]()
D.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:NH![]() 、SO
、SO![]() 、HCO
、HCO![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,某溶液中,
时,某溶液中,![]() 、
、![]() 、
、![]() 三者所占的物质的量分数
三者所占的物质的量分数![]() 随溶液pH变化关系如下图所示,下列叙述错误的是
随溶液pH变化关系如下图所示,下列叙述错误的是

A.![]() 是二元弱酸,其
是二元弱酸,其![]()
B.![]() 时,
时,![]() ,溶液中还存在
,溶液中还存在![]() 分子
分子
C.NaHR在溶液中![]() 电离程度大于水解程度
电离程度大于水解程度
D.将相同物质的量![]() 与NaHR固体完全溶于水可配得pH为
与NaHR固体完全溶于水可配得pH为![]() 的混合液
的混合液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于![]() 说法正确的是( )
说法正确的是( )
A.同一条直线上碳原子有6个
B.所有原子可能在同一平面上
C.同一平面上的原子最多有19个
D.所有碳原子不可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.甲烷的燃烧热ΔH=-890.3 kJ/mol,则CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH>-890.3 kJ/mol
B.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
C.表示硫的燃烧热的热化学方程式是S(g)+![]() O2(g)=SO3(g)△H=-315kJ/mol
O2(g)=SO3(g)△H=-315kJ/mol
D.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)△H=+566.0 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有![]() 的
的![]() 溶液,
溶液,![]() 已知含氮
已知含氮![]() 或含碳
或含碳![]() 各微粒的分布分数
各微粒的分布分数![]() 平衡时某种微粒的浓度占各种微粒浓度之和的分数
平衡时某种微粒的浓度占各种微粒浓度之和的分数![]() 与pH的关系如图所示。下列说法不正确的是
与pH的关系如图所示。下列说法不正确的是![]()
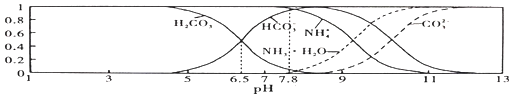
A.常温下![]()
B.向![]() 的上述溶液中逐滴滴加NaOH溶液时,
的上述溶液中逐滴滴加NaOH溶液时,![]() 和
和![]() 浓度都逐渐减小
浓度都逐渐减小
C.![]() 溶液中存在下列守恒关系:
溶液中存在下列守恒关系:![]()
D.当溶液的![]() 时,溶液中存在下列关系:
时,溶液中存在下列关系:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼元素、钙元素、铜元素在化学中站有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔。请回答下列问题:
①将乙炔通入[Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀,Cu+基态核外电子排布式为 ______。
② CaC2中C22-与O22+互为等电子体,1mol O22+中含有的![]() 键数目为 ______。
键数目为 ______。
③乙炔与氢氰酸反应可得丙烯睛(H2C=CH-C≡N),丙烯腈分子中碳原子轨道杂化类型是 ______,构成丙烯腈元素中第一电离能最大的是 ______。
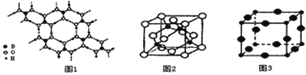
(2)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢健相连(如上图1)则1molH3BO3的晶体中有 ______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸B(OH)3H2O,它电离生成少量[B(OH)4]-和H+,则[B(OH)4]-的空间构型为 ______。
(3)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如上图2所示(黑点代表铜原子,空心圆代表M原子)。
![]() 该晶体化学式为 ______。
该晶体化学式为 ______。
![]() 已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______ (填“离子”、“共价”)化合物。
已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______ (填“离子”、“共价”)化合物。
(4)Cu3N的晶胞结构如上图3,N3-的配位数为 ______ ,Cu+半径为apm,N3-半径为bpm,Cu3N的密度为 ______gcm-3(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含![]() 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
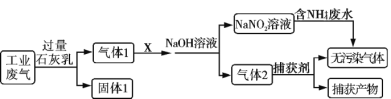
下列说法不正确的是
A.固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B.X 可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
D.处理含![]() 废水时,发生反应的离子方程式为:
废水时,发生反应的离子方程式为:![]() +
+![]()
![]() N2↑+2H2O
N2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com