
(12分)下图所示为实验制取纯净干燥的Cl2,并进行检验Cl2性质的实验装置。其中E瓶中放有干燥红色布条,F中为铜网,F右端出气管口附有脱脂棉。
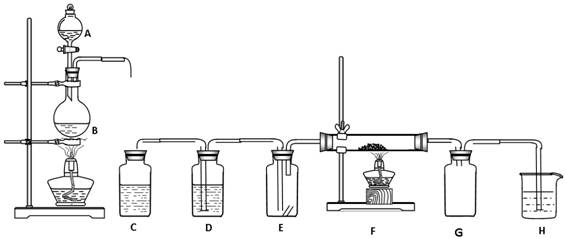
(1)洗气瓶C、D中分别盛有的试剂是 、 。
(2)E中现象是 ,
(3)F中反应的化学方程式为 。
(4)B中反应的离子方程式为 。
(5)整套装置中有两处酒精灯加热,实验时应先点燃 处的酒精灯。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
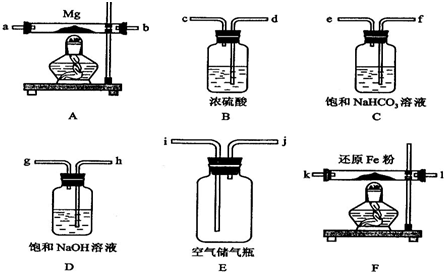
科目:高中化学 来源:2013-2014学年山东省德州市高三1月月考化学试卷(解析版) 题型:填空题
某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,某研究性学习小组欲分析其成分,实验记录如下图所示。
(1)该矿石中含有 (填化学式),请写出实验过程①中反应的离子方程式 。
(2)将氧化物Ⅱ在熔融状态下电解,可以得到某金属单质。当阳极上收集到气体33.6L(已折算成标准状况)时,阴极上得到该金属 g。
(3)试写出该金属与氧化物I反应的化学方程式 ;将该反应的产物加入到足量烧碱溶液中,请写出发生反应的离子方程式 。
(4)经进一步分析该矿石中还含有微量的SrCO3(上述方案检测不出)。锶(Sr)为第五周期ⅡA族元素。下列叙述正确的是 (填序号)。
①氯化锶(SrCl2)溶液显酸性
②SrSO4难溶于水
③工业上可以用电解SrCl2的水溶液制取金属锶(Sr)
④高纯六水氯化锶晶体(SrCl2·6H2O)必须在HCl氛围中加热才能得到SrCl2
查看答案和解析>>
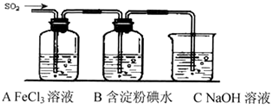
科目:高中化学 来源:2014届江西省赣州市高三上学期期中考试化学试卷(解析版) 题型:实验题
(12分)某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
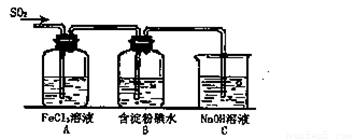
(1)SO2气体与Fe3+反应的主要产物是__ __ 。(填离子符号)
(2)下列实验方案可以用于在实验室制取所需SO2的是 。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是 。
(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中50mL NaOH溶液的物质的量浓度至少为 mol/L才能达到目的。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 ,原因是 。
(6)能表明I—的还原性弱于SO2的现象是 ,写出有关离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市青浦区高三上学期期末教学质量调研化学试卷(解析版) 题型:实验题
某兴趣小组挤究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
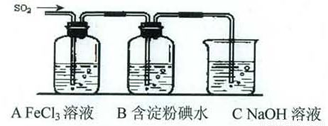
(1)SO2气体还原Fe3+反应的产物是_____________、_____________(填离子符号)。
(2)下列实验方案可以用于在实验室制取所需SO2的是____。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是_____________。
(4)如果有280 mL SO2气体(已折算为标态)进入C装置中,则C中50 mL NaOH溶液的浓度至少为_____________mol/L才能达到目的。
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____,原因是_______________________________________。
(6)能表明I-的还原性弱于SO2的现象是_________________________________________,写出有关离子方程式:_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com