
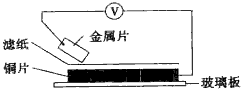
 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如表
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如表 | 金属 | 电子流动方向 | 电压 |
| 甲 | 甲→Cu | +0.78 |
| 乙 | Cu→乙 | +0.15 |
| 丙 | 丙→Cu | +1.35 |
| 丁 | 丁→Cu | +0.30 |
| A. | 在四种金属中乙的还原性最强 | |
| B. | 金属乙能从硫酸铜溶液中置换出铜 | |
| C. | 甲、丁若形成原电池时,甲为负极 | |
| D. | 甲、乙形成合金在空气中,乙先被腐蚀 |
分析 根据原电池中电子的流向判断金属的强弱,电压值越大,金属的活泼性越强,以此解答.
解答 解:甲-Cu连接时,电子从甲→Cu,所以甲的金属性大于铜;
乙-Cu连接时,电子从Cu→乙,所以乙的金属性小于铜;
丙-Cu连接时,电子从丙→Cu,所以丙的金属性大于铜;
丁-Cu连接时,电子从丁→Cu,所以丁的金属性大于铜;
A、甲、丙、丁的金属性均强于Cu,但是电压越大,金属性越强,所以活泼性是:丙>甲>丁,只有乙的活泼性弱于铜,所以在四种金属中乙的还原性最弱,故A错误;
B、金属乙的金属性小于铜,所以金属乙不能从硫酸铜溶液中置换出铜,故B错误;
C、活泼性是:丙>甲>丁,甲、丁若形成原电池时,活泼金属甲作负极,故C正确;
D、甲的金属性大于铜,乙的金属性小于铜,所以金属性是甲大于乙,甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀,故D错误.
故选C.
点评 本题考查常见金属的活动性顺序的比较方法以及金属的电化学腐蚀及防护,题目难度中等,注意把握原电池的工作原理,注意加强对数据分析能力的培养.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 mol-2•L-2 | B. | 32 mol-2•L-2 | C. | 25 mol-2•L-2 | D. | 16 mol-2•L-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压,22.4 SO3中的硫原子数目大于NA | |
| B. | 50g质量分数为34%的过氧化氢水溶液中含氧原子数目为NA | |
| C. | 5.6g Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA | |
| D. | 0.2mol AlCl3中含离子数为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
| 沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
| 流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
| 苯流失量(kg/I) | 28.8 | 14.5 | 56.7 | 100 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量相等的O2和O3中所含原子数相等 | |
| B. | 物质的量相等的O2和O3中所含分子数相等 | |
| C. | 物质的量相等的CO和CO2中所含原子数相等 | |
| D. | 物质的量相等的CO和CO2中所含碳原子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com