
【题目】84消毒液、酒精、过氧乙酸等消毒剂在抗击新型冠状病毒肺炎疫情中起到重要作用。回答下列问题:
Ⅰ.84消毒液是北京第一传染病医院(现北京地坛医院)于1984年研制的一种消毒液,主要成分为受热易分解的次氯酸钠(NaClO)。某实验小组用如图装置制备84消毒液。
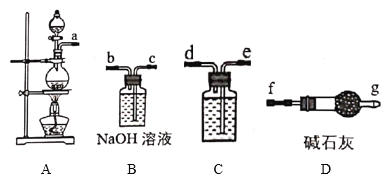
(1)A中发生反应的离子方程式为___。
(2)C中盛装试剂为__,仪器的连接顺序为a→__。
(3)制备84消毒液时,若Cl2与NaOH溶液反应温度过高,NaClO的产率将__(填“增大”“减小”或“不变”)。
Ⅱ.过氧乙酸(CH3COOOH)是无色液体,易溶于水,有强烈刺激性气味,有腐蚀性,对人的眼睛、皮肤、黏膜、上呼吸道等有强烈刺激作用,易分解,易爆炸。
(4)贮存和运输CH3COOOH时要注意的事项是__。
(5)消毒过程中需将200mL20%的过氧乙酸(密度为1.02g·cm-3)稀释为0.5%的过氧乙酸,则需加入水的体积为__![]() 。
。
(6)CH3COOOH可用H2O2和CH3COOH制备,其化学方程式为___。
(7)制备CH3COOOH过程中总会残留少量H2O2,因此CH3COOOH在使用过程中需要准确标定原液的浓度。取CH3COOOH样品![]() ,标定步骤如下:
,标定步骤如下:
a.用KMnO4标准溶液滴定H2O2;
b.当达到终点时加入足量KI溶液,发生反应:2KI+H2SO4+CH3COOOH=2KHSO4+CH3COOH+H2O+I2;
c.用1.500mol·L-1Na2S2O3标准溶液滴定生成的I2,发生反应:I2+2Na2S2O3=2NaI+Na2S4O6,消耗Na2S2O3溶液20.00mL。
测得样品中CH3COOOH的质量分数为___。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 饱和食盐水 e→d→c→b→f→g 减小 放阴暗处、避免碰撞、不能放在易燃物附近、密封 7956 CH3COOH+H2O2=CH3COOOH+H2O 19.00%
Mn2++Cl2↑+2H2O 饱和食盐水 e→d→c→b→f→g 减小 放阴暗处、避免碰撞、不能放在易燃物附近、密封 7956 CH3COOH+H2O2=CH3COOOH+H2O 19.00%
【解析】
I.本实验的目的是制备NaClO,氯气和NaOH溶液反应可以生成NaClO和NaCl,所以需要先制备氯气,装置A中利用浓盐酸和二氧化锰共热制取氯气,生成的氯气中会混有HCl气体,需要除去,可以用装置C盛放饱和食盐水进行洗气,洗气后通入NaOH溶液进行反应,未反应的氯气有毒,可以用装有碱石灰的干燥管进行吸收;
(7)该滴定实验的原理是先用高锰酸钾将双氧水氧化,然后利用过氧乙酸氧化碘离子生成碘单质,之后利用Na2S2O3标准溶液滴定生成的碘单质的量,从而确定过氧乙酸的量。
(1)装置A中利用浓盐酸和二氧化锰共热制取氯气,离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)C装置盛装饱和食盐水除去氯气中混有的杂质,根据分析可知仪器的连接顺序为a→e→d→c→b→f→g;
(3)次氯酸钠受热易分解,所以温度过高产率减小;
(4)过氧乙酸易溶于水、易分解、易爆炸、对人体有害,所以贮存和运输时应放阴暗处、避免碰撞、不能放在易燃物附近、密封;
(5)稀释过程溶质的质量不变,设加水的体积为V,水的密度为1g/cm3,所以有200mL×1.02g·cm-3×20%=(200mL×1.02g·cm-3+V×1g·cm-3)×0.5%,解得V=7956mL;
(6)根据元素守恒可知H2O2和CH3COOH制备过氧乙酸的化学方程式为CH3COOH+H2O2=CH3COOOH+H2O;
(7)消耗Na2S2O3溶液20.00mL,其浓度为1.500mol·L-1,根据反应方程式I2+2Na2S2O3=2NaI+Na2S4O6可知生成的碘单质的物质的量n(I2)=![]() =0.015mol,根据化学方程式2KI+H2SO4+CH3COOOH=2KHSO4+CH3COOH+H2O+I2可知,消耗的过氧乙酸的物质的量n(CH3COOOH)= n(I2)=0.015mol,所以样品中过氧乙酸的质量分数为
=0.015mol,根据化学方程式2KI+H2SO4+CH3COOOH=2KHSO4+CH3COOH+H2O+I2可知,消耗的过氧乙酸的物质的量n(CH3COOOH)= n(I2)=0.015mol,所以样品中过氧乙酸的质量分数为![]() =19.00%。
=19.00%。


科目:高中化学 来源: 题型:
【题目】根据下面的信息,下列叙述正确的是( )

A. 2 mol H2(g)跟 1 mol O2(g)反应生成 2 mol H2O(g)吸收能量为490 kJ
B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 1 mol H2(g) 跟0.5mol O2(g) 反应生成 1 mol H2O(l)释放能量为245 kJ
D. 2molH2O (g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前我国研制的稀土催化剂催化转化汽车尾气示意图如下:
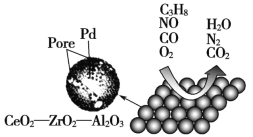
(1)Zr原子序数为40,价电子排布式为4d25s2,它在周期表中的位置是_______________。
(2)图中互为等电子体的两种气体分子是_____________。
(3)C3H8中所有碳原子的杂化方式是___________。
(4)图中属于非极性的气体分子是_______________________。
Fe、Mn元素的部分电离能数据列于下表中
元素 | Fe | Mn | |
电离能(kJ·mol-1) | I1 | 759 | 717 |
I2 | 1561 | 1509 | |
I3 | 2957 | 3248 | |
(5)从上表两元素部分电离能数据比较的可知,气态Mn2+再失去一下电子比气态Fe2+再夫去一个电子难,原因是_____________。
(6)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,镍原子在基态时核外电子排式为_____________,[Ni(CO)4]的配体是_________,配位原子是__________。
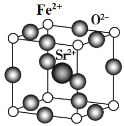
(7)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图所示,则与每个Sr2+紧邻的O2-有______个。
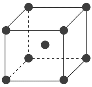
(8)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格,原子半径为apm,相对原子质量为b,阿伏加德罗常数为NA,试计算晶体铌的密度为______________g·cm-3(用来a、b、NA表示计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中山大学化学科研团队首次将CsPbBr3纳米晶锚定在氨基化RGO包覆的α—Fe2O3(α—Fe2O3/Amine—RGO/CsPbBr3),构筑Z—Scheme异质结光催化剂,可有效降低电荷复合,促进电荷分离,从而提升光催化性能。光催化还原CO2和氧化H2O的反应路径如图。下列说法正确的是( )
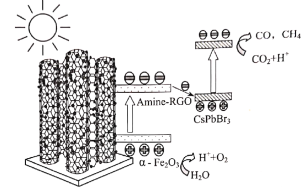
A.该路径能量转化形式为电能→化学能
B.该光催化转化反应可以阻止温室效应
C.“CsPbBr3纳米晶”表面发生了还原反应
D.该催化转化的总反应涉及到非极性共价键、极性共价键的断裂和形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO![]() 。关于该物质的说法正确的是( )
。关于该物质的说法正确的是( )
A. 该物质属于两性氢氧化物
B. 该物质是Al(OH)3和Na2CO3的混合物
C. 1 mol NaAl(OH)2CO3最多可消耗3 mol H![]()
D. 该药剂不适合于胃溃疡患者服用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氟碳铈矿(主要成分![]() )提取
)提取![]() 的一种工艺流程如下:
的一种工艺流程如下:
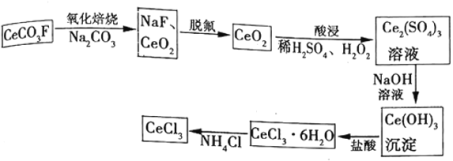
请回答下列问题:
(1)脱氟过程的实验操作是________,酸浸过程中加入![]() 的作用是________。
的作用是________。
(2)常温下,若溶液中的![]() 沉淀完全,此时溶液的
沉淀完全,此时溶液的![]() 为________(己知
为________(己知![]() )。
)。
(3)准确称取![]() 样品置于锥形瓶中,加入适量过硫酸铵
样品置于锥形瓶中,加入适量过硫酸铵![]() 溶液将
溶液将![]() 氧化为
氧化为![]() ,再用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗30.00mL标准溶液。(己知:
,再用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗30.00mL标准溶液。(己知:![]() )
)
①已知:过二硫化酸的结构式为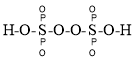 ,其中
,其中![]() 元素的化合价为________。
元素的化合价为________。
②该样品中![]() 的质量分数为________(精确到
的质量分数为________(精确到![]() )。
)。
③若使用久置的![]() 标准溶液进行滴定,测得该
标准溶液进行滴定,测得该![]() 样品的质量分数将________(填“偏大”“偏小”或“无影响”)。
样品的质量分数将________(填“偏大”“偏小”或“无影响”)。
(4)脱氟过程中产生的![]() 因活性弱于熔融的氟氢化钾
因活性弱于熔融的氟氢化钾![]() ,故现代工业以电解熔融的氟氢化钾和氟化氢
,故现代工业以电解熔融的氟氢化钾和氟化氢![]() 混合物制备氟单质,电原理为
混合物制备氟单质,电原理为![]() 装置如图所示。已知
装置如图所示。已知![]() 是一种酸式盐,则阴极上发生的电极反应式为________。电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是________。
是一种酸式盐,则阴极上发生的电极反应式为________。电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是________。
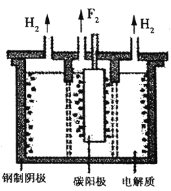
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定量的硫酸铜溶液,实验装置如图甲。电解过程中的实验数据如图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。则下列说法不正确的是
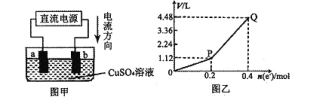
A.电解过程中,a电极表面先有红色物质析出,后有气泡产生
B.b电极上发生的反应方程式为:4OH-一4e-=2H2O+O2↑
C.曲线O一P段表示H2的体积变化
D.Q点时收集到的混合气体中H2和O2体积比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丹参素(I)是一种具有改善心脏功能、抗血栓形成、促进组织的修复与再生等多种作用的药物。该药物的一种合成路线如下:
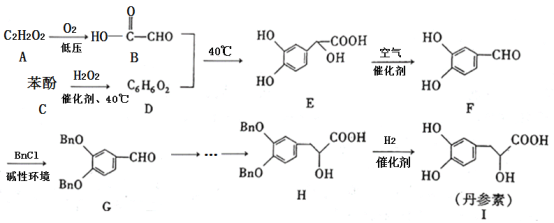
已知:![]() 代表苄基(
代表苄基(![]() )
)
请回答下列问题:
(1)![]() 的结构简式为_______,
的结构简式为_______,![]() 中所含官能团的名称为羟基、______。
中所含官能团的名称为羟基、______。
(2)![]() 的反应类型为_______,该反应的目的是________。
的反应类型为_______,该反应的目的是________。
(3)写出![]() 的化学方程式:________。
的化学方程式:________。
(4)苯酚与![]() 反应可以制备物质
反应可以制备物质![]() (
(![]() )。
)。![]() 是
是![]() 的同系物,相对分子质量比
的同系物,相对分子质量比![]() 大14。则符合下列条件的
大14。则符合下列条件的![]() 的同分异构体有______种(不考虑立体异构)。
的同分异构体有______种(不考虑立体异构)。
①苯环上只有两个取代基 ②能与![]() 溶液发生显色反应 ③能发生银镜反应 ④红外光谱表明分子中不含醚键
溶液发生显色反应 ③能发生银镜反应 ④红外光谱表明分子中不含醚键
其中核磁共振氢谱有6组峰,且峰面积之比为![]() 的结构简式为________(写出一种即可)。
的结构简式为________(写出一种即可)。
(5)参照丹参素的上述合成路线,以![]() 为原料,设计制备
为原料,设计制备![]() 的合成路线:____________。
的合成路线:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com