
| A�� | ԭ�����Һ��c��Na+��=0.2 mol•L-1 | |
| B�� | ������Һ��c��H+��=0.4mol•L-1 | |
| C�� | �����������й�ת��0.4 mol���� | |
| D�� | ����õ���Cu�����ʵ���Ϊ0.05mol |
���� ��������ʵ���=$\frac{1.12L}{22.4L/mol}$=0.05mol��������Cu2+�ȷŵ磬��H+�ŵ磬������OH-�ŵ磬������������0.05molO2ʱת�Ƶ������ʵ���=0.05mol��4=0.2mol������������0.05molH2ת�Ƶ������ʵ���=0.05mol��2=0.1mol������0.1mol����ΪCu2+ת�Ƶģ���n��Cu2+��=$\frac{0.1mol}{2}$=0.05mol��
A��c��Cu2+��=$\frac{0.05mol}{0.5L}$=0.1mol/L�����ݵ���غ����c��Na+����
B��ǰһ��ʱ����ˮ������ͭ����ͭ������ȫ�ŵ��ֻ���ˮ����������ͭ���������������ӣ�
C������������ת�Ƶ���֮���ϵʽ����ת�Ƶ������ʵ�����
D���������Ϸ���֪��n��Cu2+��=$\frac{0.1mol}{2}$=0.05mol������Cuԭ���غ���㣮
��� �⣺��������ʵ���=$\frac{1.12L}{22.4L/mol}$=0.05mol��������Cu2+�ȷŵ磬��H+�ŵ磬������OH-�ŵ磬������������0.05molO2ʱת�Ƶ������ʵ���=0.05mol��4=0.2mol������������0.05molH2ת�Ƶ������ʵ���=0.05mol��2=0.1mol������0.1mol����ΪCu2+ת�Ƶģ���n��Cu2+��=$\frac{0.1mol}{2}$=0.05mol��
A��c��Cu2+��=$\frac{0.05mol}{0.5L}$=0.1mol/L�����ݵ���غ��c��Na+��=c��NO3-��-2��Cu2+��=0.3mol/L-2��0.1mol/L=0.1mol/L����A����
B��ǰһ��ʱ����ˮ������ͭ����ͭ������ȫ�ŵ��ֻ���ˮ����������ͭ���������������ӣ�����2Cu2++2H2O$\frac{\underline{\;���\;}}{\;}$O2��+2Cu+4H+֪������n��H+��=2n��Cu��=2��0.05mol=0.1mol����H+��=$\frac{0.1mol}{0.5L}$=0.2mol/L����B����
C���������Ϸ���֪��ת�Ƶ������ʵ���Ϊ0.2mol����C����
D���������Ϸ���֪��n��Cu2+��=$\frac{0.1mol}{2}$=0.05mol������Cuԭ���غ��n��Cu��=n��Cu2+��=0.05mol����D��ȷ��
��ѡD��
���� ���⿼����ԭ����Ϊ��Ƶ���㣬��ȷ���ӷŵ�˳���ǽⱾ��ؼ���֪�������缫�Ϸ����ķ�Ӧ��ע�����������֮��Ĺ�ϵ����Ŀ�ѶȲ���


 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢݢ� | B�� | �٢ۢ� | C�� | �ڢޢ� | D�� | �ڢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
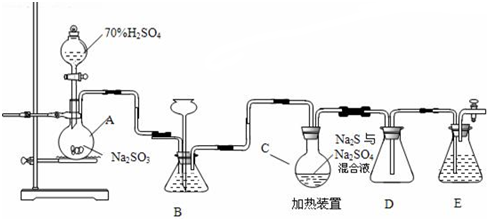
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NiOOH | B�� | Ni��OH��2 | C�� | Cd | D�� | Cd��OH��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 L 1mol/L NaHCO3��Һ�������ƶ�����������Ϊ3NA | |
| B�� | ���³�ѹ�£�1.06g Na2CO3����Na+��ĿΪ0.02NA | |
| C�� | 1 mol Na2O2��CO2��Ӧ����ת��Ϊ2 NA | |
| D�� | 40g NaOH�ܽ���1 Lˮ�У��õ���Һ�����ʵ���Ũ��Ϊ1 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ﶼ����ͬ�ַ��ӹ��� | |
| B�� | ����������ǵ��ʣ�Ҳ�����ǻ����� | |
| C�� | ��Ȫˮ�Ǵ����� | |
| D�� | �����������ͬ��Ԫ����ɵ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
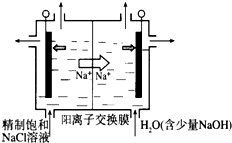
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com