
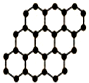
 C和Si元素在化学中占有极其重要的地位.
C和Si元素在化学中占有极其重要的地位.分析 (1)CO2属于分子晶体,熔化时克服的微粒间作用力是分子间作用力;SiO2属于是原子晶体,熔化时克服的微粒间作用力是共价键,化学键比分子间作用强得多;
(2)SiO2晶体是原子晶体,一个硅与四个氧相连,一个氧与两个硅相连形成正四面体;
(3)利用均摊法计算.
解答 解:(1)CO2属于分子晶体,熔化时克服的微粒间作用力是分子间作用力;SiO2属于是原子晶体,熔化时克服的微粒间作用力是共价键,化学键比分子间作用强得多,所以二氧化硅熔点高于二氧化碳气体,故答案为:分子;分子间作用;原子;共价键;<;
(2)SiO2晶体是原子晶体,一个硅与四个氧相连,一个氧与两个硅相连形成正四面体,故答案为:4;2;
(3)石墨层状结构中,每个碳原子被三个正六边形共用,所以平均每个正六边形占有的碳原子数=6×$\frac{1}{3}$=2,故答案为:2.
点评 本题考查了物质结构、基本概念,难度不大,利用均摊法进行有关计算即可.


科目:高中化学 来源: 题型:选择题

| A. | 该装置实现化学能向电能的转化 | |
| B. | 该电池的总反应为2NO+O2═2NO2 | |
| C. | NiO电极的电极反应式:NO+O2--2e-═NO2 | |
| D. | 当有2.24L的O2参与反应时,转移了0.4mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l.
已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na3[AlF6] | B. | Na2[SiF6] | C. | [Cu(NH3)4](OH)2 | D. | [Pt(NH3)2Cl4]Cl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体在受热熔化过程中一定存在化学键的断裂 | |
| B. | 晶体的自范性是指在适宜条件下晶体能够自发地呈现规则的多面体外形 | |
| C. | 区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验 | |
| D. | 晶体的各向异性取决于微观粒子的排列具有特定的方向性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷 | B. | 甲醛 | C. | CO | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知化学反应N2+3H22NH3的能量变化如图所示:
已知化学反应N2+3H22NH3的能量变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | $\frac{c({H}^{+})}{c(HF)}$ | C. | $\frac{c({F}^{-})}{c({H}^{+})}$ | D. | $\frac{c({H}^{+}).c({F}^{-})}{c(HF)}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com