
已知反应2H2S+SO2![]() 2S+2H2O,常温下,向20L真空容器中通入a mol H2S和b mol SO2(a和b都是正整数,且a≤5,b≤5),反应完全后,容器内可能达到的最大密度约为
2S+2H2O,常温下,向20L真空容器中通入a mol H2S和b mol SO2(a和b都是正整数,且a≤5,b≤5),反应完全后,容器内可能达到的最大密度约为
[ ]
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 HS-+OH-
HS-+OH- HS-+OH-
HS-+OH-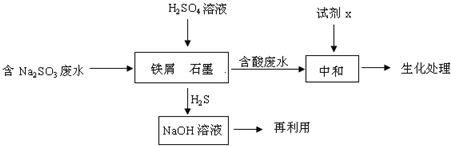
查看答案和解析>>
科目:高中化学 来源: 题型:
A.H2S、H2SO3、I-、Br-
B.I-、Br-、H2SO3、H2S
C.H2S、I-、Br-、H2SO3
D.I-、Br-、H2S、H2SO3
查看答案和解析>>
科目:高中化学 来源:2011届北京市丰台区高三下学期统一练习(一)(理综)化学部分 题型:填空题
(14分)工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因 。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为 。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)  Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法: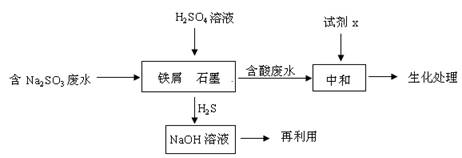
①中和含酸废水工业常用的试剂x是 。
②写出H2S气体与足量NaOH溶液反应的化学方程式 。
③铁屑与石墨能形成微型原电池,SO32—在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32—在酸性条件下放电生成H2S的电极反应式: 。
④已知:2H2S(g)+O2(g) =" 2" S(s) +2 H2O(l) △H=" —632.8" kJ/mol
SO2 (g) =" S(s)" + O2(g) △H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年北京市丰台区高三下学期统一练习(一)(理综)化学部分 题型:填空题
(14分)工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
① 测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因 。
② 含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为 。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)
 Na2S(s)
+ 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s)
+ 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:

① 中和含酸废水工业常用的试剂x是 。
② 写出H2S气体与足量NaOH溶液反应的化学方程式 。
③ 铁屑与石墨能形成微型原电池,SO32—在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32—在酸性条件下放电生成H2S的电极反应式: 。
④ 已知:2H2S(g)+O2(g) = 2 S(s) +2 H2O(l) △H= —632.8 kJ/mol
SO2 (g) = S(s) + O2(g) △H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com