
| A. | 在稀溶液中,1mol酸和1mol碱完全反应所放出的热量叫做中和热 | |
| B. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 | |
| C. | 热化学方程式中,各物质前的化学计量数不表示分子个数 | |
| D. | 如果反应物所具有的总能量低于生成物所具有的总能量,则发生的反应是放热反应 |
分析 A.中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量;
B.根据物质三态之间的转变也存在热量的变化;
C.热化学方程式中的化学计量数只表示物质的量,不表示微粒数,系数可以用分数表示;
D.反应物所具有的总能量小于生成物所具有的总能量,属于吸热反应;
解答 解:A.中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,弱酸、弱碱溶液中存在电离平衡,电离过程是吸热过程,故A错误;
B.因物质三态之间的转变也存在热量的变化,而物质三态之间的转变是物理变化,所以能量变化不一定会引起化学变化,故B称为;
C.热化学方程式中的化学计量数只表示反应物或生成物的物质的量,不表示微粒数,系数可以用分数表示,故C正确;
D.反应物所具有的总能量小于生成物所具有的总能量,属于吸热反应;反应物所具有的总能量大于生成物所具有的总能量,属于放热反应,故D错误.
故选C.
点评 本题考查了化学反应中的能量变化、热化学方程式书写,侧重于放热反应和吸热反应的辨析、中和热的概念等,属于基础知识的考查,难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Al | Si | S | Cl | Ar |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
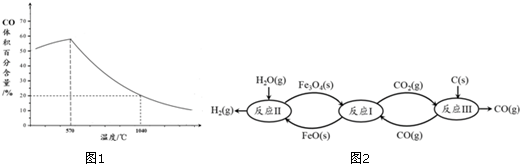

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
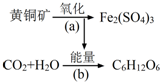 利用某些细菌的特殊生物催化作用,可以使矿石中的金属在水溶液中溶解出来.例如氧化亚铁硫杆菌能利用空气中的氧气,在溶液中将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:
利用某些细菌的特殊生物催化作用,可以使矿石中的金属在水溶液中溶解出来.例如氧化亚铁硫杆菌能利用空气中的氧气,在溶液中将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
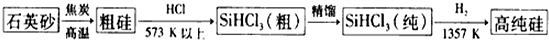
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
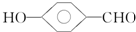 的沸点比
的沸点比 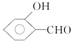 高,原因是
高,原因是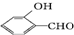 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质遇浓硝酸呈现黄色 | |
| B. | 淀粉溶液遇单质碘呈现蓝色 | |
| C. | 苯酚显弱酸性,其溶液可以使石蕊试液变红色 | |
| D. | 苯酚在空气中氧化呈现粉红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com