
【题目】有一镁铝混合物重a g,取其一半和足量的盐酸反应,放出V1L的氢气。取其另一半和足量的NaOH溶液反应,放出V2L的氢气(均为标况下)。求混合物中镁和铝的质量比。_____________
科目:高中化学 来源: 题型:
【题目】由锌、铁、铝、镁四种金属中的两种组成的混合物23g,与足量的盐酸反应产生的氢气标准状况下为22.4L,则两种金属组成的混合物可能是( )
A. 锌与镁 B. 铁与锌 C. 铝与铁 D. 镁与铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I下图表示一些晶体中的某些结构,他们分别是氯化钠、氯化铯、干冰、金刚石、石墨结构中的某一种的某一部分(黑点可表示不同或相同的粒子)。

(1)其中代表金刚石的是_______(填编号字母,下同),金刚石中每个碳原子与_____个碳原子最接近且距离相等。
(2)其中代表石墨的是________,其中每个正六边形占有的碳原子数平均为________个;
(3)其中表示氯化钠的是___,每个钠离子周围与它最接近且距离相等的钠离子有___个;
(4)代表氯化铯的是______,每个铯离子与______个氯离子紧邻;
(5)代表干冰的是_______,每个二氧化碳分子与________个二氧化碳分子紧邻;
II将少量CuSO4粉末溶于盛有水的试管中得到一种天蓝色溶液,先向试管里的溶液中滴加氨水,首先形成蓝色沉淀。继续滴加氨水,沉淀溶解,得到深蓝色溶液;再加入乙醇溶剂,将析出深蓝色的晶体。
(1)溶液中呈天蓝色微粒的化学式是______,1 mol该天蓝色微粒所含的σ键数目为______。
(2)加入乙醇的作用是_____________________。
(3)写出蓝色沉淀溶解成深蓝色溶液的离子方程式______________。
(4)得到的深蓝色晶体是[Cu(NH3)4]SO4·H2O,晶体中Cu2+与NH3之间的化学键类型为_____, 该晶体中配体分子的空间构型为_________。(用文字描述)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐在化学工业中有重要的应用,请回答下列问题
(1)用离子方程式表示FeCl3可作净水剂的原因:___________________ 。
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为_____ , 向Na2S溶液中加入AlCl3溶液时,产生白色沉淀和有臭鸡蛋味的气体,其离子方程式为:_________________。
(3)c(NH4+)相等的下列溶液① NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4
⑤NH3 H2O,溶液的物质的量浓度由小到大的顺序是__________ (用序号表示)
(4)已知t ℃时AgCl的Ksp=2×10-10 ;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列正确的是 _______
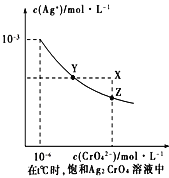
A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.t ℃时,在饱和Ag2CrO4溶液中加入K2CrO4 可使溶液由Y点到X点
C.在t ℃时,以0.01mol/L AgNO3溶液滴定20mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混合溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
(5)已知某温度时:Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=1×10-20。在该温度下向Fe3+、Cu2+均为0.01molL-1的溶液中逐滴加入NaOH溶液,要Fe3+完全沉淀,而Cu2+不产生沉淀,溶液中PH应控制的范围是_______。(当离子浓度小于1×10-5mol/L时,认为完全沉淀)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为﹣285.8kJ/mol、﹣283.0kJ/mol和﹣726.5kJ/mol.请写出CH3OH(l)完全燃烧生成二氧化碳和液态水的热化学方程式:______________________________.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K)
温度/℃ | 250 | 300 | 350 | |
K/L2mol﹣2 | 2.041 | 0.270 | 0.012 |
①该反应的平衡常数的表达式是____________,由表中数据判断△H__0(填“>”、“=”或“<”)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为______,则反应速率v(H2)=_______.
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的![]() ,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇)._______.
,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇)._______.

(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的电极反应式__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+、SO42-、Mg2+ 和X四种离子以物质的量之比1∶2∶1∶1大量共存于同一溶液中,X可能是
A.NH4+ B.OH- C.CO32- D.Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图像的说法中正确的是

A.图①表示将SO2气体通入溴水中
B.图②表示反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0的平衡常数K随温度的变化
2NH3(g) ΔH<0的平衡常数K随温度的变化
C.图③中阴、阳两极收集到的气体体积之比一定为1∶1
D.图④中的ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,向10L容积不变的密闭容器中加入1.0molNH2COONH4,发生反应NH2COONH4(s)![]() CO2(g)+2NH3(g) ΔH>0。5min达到平衡时,测得容器中NH2COONH4(s)的物质的量为0.2mol。下列说法正确的是
CO2(g)+2NH3(g) ΔH>0。5min达到平衡时,测得容器中NH2COONH4(s)的物质的量为0.2mol。下列说法正确的是
A. 0~5min内,v(CO2)=0.16mol·L-1·min-1
B. 氨气体积分数不变时,该反应一定达到平衡状态
C. 平衡后,缩小容器容积,重新建立平衡时,c(CO2)增大
D. 其他条件不变,若将原容器改为绝热容器,则达到平衡时,NH2COONH4的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,室温下向盛有3.0mL NO的试管中缓缓通入1.5mL O2(所有气体体积均在标准状况下测定)。

试回答下列问题:
(1)写出观察到的现象(可不写满,也可补充):
①____________________________________________________________________;
②____________________________________________________________________;
③____________________________________________________________________。
(2)最终试管中剩余的气体是________,体积为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com