
下列化学用语表达正确的是( )
A.Na2S的电子式:
B.铯?137:137Cs
C.O2-的结构示意图: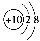
D.乙烯分子的球棍模型: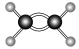
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2014高考化学二轮专题突破 专题十七有机化学基础练习卷(解析版) 题型:推断题
二甲氧苄胺嘧啶是一种用于家禽细菌感染防治药。其合成路线如下:
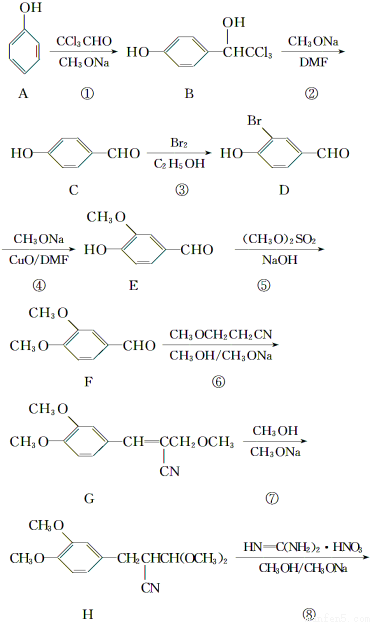
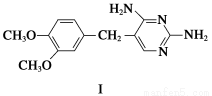
(1)化合物F的含氧官能团名称为________、__________;合成路线中,步骤①、④的反应类型分别为______________、____________。
(2)化合物B的核磁共振氢谱中有________个峰。
(3)写出F与新制氢氧化铜反应的化学方程式_______________________________。
(4)写出同时满足下列条件的E的同分异构体的结构简式:__________________________。
Ⅰ.分子中苯环上有两个取代基;
Ⅱ.能发生银镜反应;
Ⅲ.不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应;
Ⅳ.核磁共振氢谱显示有4个峰。
(5)实验生产的产品中存在一种结构为 的副产物,为了使该产物的含量降到最低,需要合成路线中第________步反应的工艺最优化。
的副产物,为了使该产物的含量降到最低,需要合成路线中第________步反应的工艺最优化。
(6)已知 。化合物
。化合物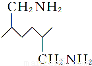 是合成染料的中间体,请写出以氯乙烷为原料制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
是合成染料的中间体,请写出以氯乙烷为原料制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2OH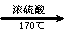 CH2=CH2
CH2=CH2 ?CH2—CH2?
?CH2—CH2?
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题八电化学练习卷(解析版) 题型:选择题
太阳能光伏发电系统是被称为“21世纪绿色光源”的半导体照明(LED)系统(如图)。已知发出白光的LED是将GaN芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成。下列说法中不正确的是( )
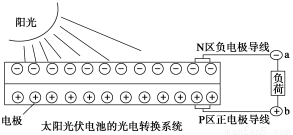
A.光伏发电是将太阳能转变为电能
B.上图中N区半导体为负极,P区半导体为正极,电流从a流向b
C.YAG中钇显+3价
D.Ga与N在元素周期表中不处于同一主族
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题五离子反应练习卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是( )
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO=BaCO3↓+NH3·H2O+H2O
B.氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+=Fe3++3H2O
C.向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O
D.向AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH↓+NH4+
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题二化学用语及常用计量练习卷(解析版) 题型:选择题
已知硫铁矿在沸腾炉中煅烧(4FeS2+11O2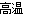 8SO2+2Fe2O3),通入沸腾炉中的气体原料是过量的空气,其中N2的体积分数为0.80,O2的体积分数为0.20,则沸腾炉排出的气体中SO2的体积分数可能是( )
8SO2+2Fe2O3),通入沸腾炉中的气体原料是过量的空气,其中N2的体积分数为0.80,O2的体积分数为0.20,则沸腾炉排出的气体中SO2的体积分数可能是( )
A.0.18 B.0.12 C.0.16 D.0.20
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题九化学反应速率化学平衡练习卷(解析版) 题型:填空题
工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)  2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成2n mol H—H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
NH3 | 0 | 0.20 |
| 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题九化学反应速率化学平衡练习卷(解析版) 题型:选择题
在容积恒定的密闭容器中,一定量的SO2与1.1 mol O2发生反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0。当气体的物质的量减少0.315 mol时,反应达到平衡,SO2的平衡转化率是90%。下列说法正确的是( )
2SO3(g) ΔH<0。当气体的物质的量减少0.315 mol时,反应达到平衡,SO2的平衡转化率是90%。下列说法正确的是( )
A.相同条件下,平衡时若充入稀有气体,SO2的转化率增大
B.反应开始时,向容器中通入的SO2的物质的量是0.7 mol
C.保持其他条件不变,仅降低温度,正反应速率减小程度比逆反应速率减小程度大
D.保持其他条件不变,仅缩小容器体积,反应达到平衡时容器中有1.485 mol气体
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题七化学反应与能量练习卷(解析版) 题型:填空题
根据下列条件计算有关反应的焓变:
(1)已知:Ti(s)+2Cl2(g)=TiCl4(l)ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)=2NaCl(s) ΔH=-882.0 kJ·mol-1
Na(s)=Na(l) ΔH=+2.6 kJ·mol-1
则反应TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)的ΔH=________ kJ·mol-1。
(2)已知下列反应数值:
反应序号 | 化学反应 | 反应热 |
① | Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) | ΔH1=-26.7 kJ·mol-1 |
② | 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) | ΔH2=-50.8 kJ·mol- |
③ | Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) | ΔH3=-36.5 kJ·mol-1 |
④ | FeO(s)+CO(g)=Fe(s)+CO2(g) | ΔH4 |
则反应④的ΔH4=____________ kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题8电化学原理练习卷(解析版) 题型:填空题
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Na+、K+、Cu2+ |
阴离子 | S |
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:

(1) M为直流电源的 极,b电极上发生的电极反应为 。
(2)计算e电极上生成的气体在标准状况下的体积为 。
(3)写出乙烧杯中的总反应的离子方程式: 。
(4)要使丙烧杯中的C溶液恢复到原来的状态,需要进行的操作是(写出要加入的物质和质量) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com