
| c |
| 2 |
| 4×10-8×2 |
| 2.5×10-5mol/L |


科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.从溶解的整个过程来看,既包含着物理变化,又包含着化学变化 |
| B.氯化钠溶于水达到饱和后,溶解过程并没有停止 |
| C.只要溶解过程发生,就一定能建立溶解平衡 |
| D.将K37Cl投入到K35Cl的饱和溶液中,溶液中K35Cl的质量会减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| O | -3 |
| O | 2-3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Pb为正极,被氧化 |
| B.溶液的pH不断减小 |
C.S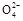 只向PbO2处移动 只向PbO2处移动 |
| D.电解液密度不断减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
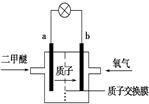
| A.a极为电池的负极 |
| B.电池工作时电流由b极沿导线经灯泡到a极 |
| C.电池正极的电极反应式为4H++O2+4e-===2H2O |
| D.电池工作时,1 mol二甲醚被氧化时有6 mol电子发生转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com