
| A. | SO2和SiO2 | B. | CO2 和NaCl | C. | NH4Cl 和HCl | D. | H2O2和C3H6 |
分析 根据晶体的类型和所含化学键的类型分析,离子晶体中阴阳离子以离子键结合可能含有共价键,原子晶体中原子以共价键结合,分子晶体中分子之间以范德华力结合,分子内部存在化学键.
解答 解:A、固体SO2是分子晶体,二氧化硅是原子晶体,二氧化硅、二氧化碳都只含共价键,故A错误;
B、CO2是分子晶体,CO2中只含共价键,NaCl是离子晶体,KCl中只含离子键,故B错误;
C、NH4Cl 是离子晶体,NH4Cl 中含离子键和共价键,固体HCl分子晶体,HCl中只含共价键,故C错误;
D、H2O2和C3H6都是分子晶体,分子中都含极性共价键和非极性共价键,故D正确;
故选:D.
点评 本题考查了化学键类型和晶体类型的关系.判断依据为:离子晶体中阴阳离子以离子键结合,原子晶体中原子以共价键结合,分子晶体中分子之间以范德华力结合,分子内部存在化学键.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未加盐酸时:c(OH-)>c(Na+)=c(NH3•H2O) | B. | 加入10mL盐酸时:c(NH4+)+c(H+)=c(OH-) | ||
| C. | 加入盐酸至溶液pH=7时:c(Cl-)=c(Na+) | D. | 加入20mL盐酸时:c(Cl-)=c(NH4+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
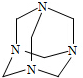 乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+为正四面体形 | B. | CS2为直线形 | ||
| C. | HCN为折线形(V形) | D. | PCl3为三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中一定含有化学键 | |
| B. | 共价化合物一定不含有离子键 | |
| C. | 含有金属元素的离子一定是阳离子 | |
| D. | 非金属元素的化合物一定不含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com