
分析 ①单原子分子不存在共价键;
②金属晶体含有组成微粒为阳离子和电子;
③根据晶体类型判断熔点高低;
④离子晶体中一定存在离子键,可能有共价键;
⑤SiO2晶体中每个硅原子形成4个共价键;
⑥分子间作用力与分子稳定性无关;
⑦氯化钠晶体中只有离子键;
⑧同主族元素从上到下元素的非金属性逐渐减弱,对应的氢化物的稳定性逐渐减弱;
⑨电子层结构相同,核电荷数越大,离子半径越小;电子层数越大,半径越大;
⑩元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强.
解答 解:①单原子分子不存在共价键,只存在分子间作用力,故①错误;
②晶体只要有阳离子不一定有阴离子,如金属晶体含有组成微粒为阳离子和电子,故②错误;
③晶体中熔点高低一般顺序是:原子晶体>离子晶体>分子晶体;在原子晶体中,原子半径越大熔点越低;在离子晶体中,离子半径越大,熔点越低,电荷越多,熔点越高;在分子晶体中,物质的熔点与相对分子质量成正比(含有氢键的物质除外),所以这几种物质的熔点高低顺序是:金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低,故③正确;
④离子晶体中一定存在离子键,可能有共价键,如NaOH中既有离子键又有共价键,分子晶体中肯定没有离子键,故④错误;
⑤SiO2晶体中每个硅原子形成4个共价键,所以每个硅原子与四个氧原子以共价键相结合,故⑤错误;
⑥分子的稳定性属于化学性质,与共价键有关,分子间作用力与稳定性无关,故⑥错误;
⑦氯化钠晶体中只有离子键,则氯化钠熔化时离子键被破坏,故⑦正确;
⑧同主族元素从上到下元素的非金属性逐渐减弱,对应的氢化物的稳定性逐渐减弱,则非金属性:F>Cl>Br>I,所以稳定性:HF>HCl>HBr>HI,故⑧错误;
⑨电子层结构相同,核电荷数越大,离子半径越小,则半径Na+>Mg2+,电子层数越大,半径越大,则Cl->K+>Na+,所以微粒半径:Cl->K+>Na+>Mg2+,故⑨错误;
⑩非金属性Si<P<S<Cl,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性为HClO4>H2SO4>H3PO4>H2SiO3,故⑩正确.
故答案为:③⑦⑩.
点评 本题考查的知识点较多,涉及共价键、离子键、分子间作用力、晶体熔点比较、同周期、同主族元素的性质变化规律及元素非金属性的比较方法等,题目侧重于基础知识的考查,难度不大,注意相关知识的积累.


科目:高中化学 来源: 题型:解答题
 实验室常用KMnO4与浓盐酸反应制取氯气:
实验室常用KMnO4与浓盐酸反应制取氯气:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═AlO${\;}_{2}^{-}$+2H2↑ | |
| B. | 铜片投入少量FCl3溶液中:3Cu+2Fe3+═2Fe+3Cu2+ | |
| C. | .Ca(CHO3)2溶液与足量澄清石灰水混合:Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| D. | 用铁棒作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀硫酸 | Na2S | AgNO3与 AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| B | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性:MnO2>Cl2>Br2 | |
| C | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA | |
| B. | 将1molFeCl3水解制成胶体,所得胶体的胶粒数为NA | |
| C. | 0.5mol NH4HSO4晶体中,含有H+数目为0.5NA | |
| D. | 18gD2O含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂粉精的主要成分:CaCl2 | |
| B. | 乙烯的结构简式:CH2=CH2 | |
| C. | Na+的结构示意图: | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度(t℃)下的溶液中,c(H+)=10-xmol•L-1,c(OH-)=10-ymol•L-1,x与y的关系如图所示.请回答下列问题:
某温度(t℃)下的溶液中,c(H+)=10-xmol•L-1,c(OH-)=10-ymol•L-1,x与y的关系如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
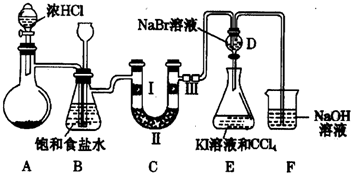
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com