
元素周期表中短周期的一部分如图,关于X、Y、Z、W、Q说法正确的是
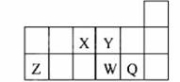
A.元素Y与元素Z的最高正化合价之和的数值等于9
B.原子半径的大小顺序为:W>Z>Y
C.离子半径的大小顺序为:W2->Y2->Z3+
D.W的气态氢化物的热稳定性和还原性均比Q的氢化物的强
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源:2016届安徽省等六校教研会高三第一次联考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A、Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O
B、0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
C、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
D、向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2 +H2O = HClO+HSO3-
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期开学考试化学试卷(解析版) 题型:填空题
CaO2难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等。
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)===CaO2(s)+2H2O(l);ΔH<0
不同浓度的H2O2对反应生成CaO2产率的影响如下表:
H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
(1)分析题给信息,解释H2O2浓度大于20%后CaO2产率反而减小的原因: 。
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量。
步骤1:准确称取0.04~0.05 g过氧化钙样品,置于250 mL的锥形瓶中;
步骤2:分别加入30 mL蒸馏水和2 mL盐酸(3 mol·L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5 mL KI溶液(100 g·L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后________,用硫代硫酸钠标准溶液继续滴定,________,记录数据;
步骤5:平行测定3次,计算试样中CaO2的质量分数。滴定时发生的反应为2Na2S2O3+I2===Na2S4O6+2NaI。
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是 。
(3)加入KI溶液后发生反应的离子方程式为 。
(4)请补充完整实验步骤4中的内容:____________;____________。
查看答案和解析>>
科目:高中化学 来源:2016届山东省枣庄市高三9月阶段性学情检测化学试卷(解析版) 题型:填空题
化合物甲和NaAlH4都是重要的还原剂。一定条件下金属钠和H2反应生成甲。甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。将4.80g甲加热至完全分解,得到金属钠和2.24 L(已折算成标准状况)的H2。请推测并回答:
(1)甲的化学式__________。
(2)甲与AlCl3反应得到NaAlH4的化学方程式: __________。
(3)NaAlH4与水发生氧化还原反应的化学方程式: __________。
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3)脱锈过程发生的化学方程式_________ 。
(5)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到的固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2,即可证明得到的甲一定是纯净的。
判断该同学设想的制备和验纯方法的合理性并说明理由___________ 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省新高三开学初模拟检测化学试卷(解析版) 题型:选择题
镁铁混合物13.8g溶解在足量某浓度的稀硝酸中,完全反应,其还原产物只有一氧化氮(0.3mol),则向反应后的溶液中加入足量的NaOH溶液,可生成的沉淀质量为
A.26 B.29.1g C.29.5g D.24g
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。再向反应后 的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列说法正确的是
A.白色沉淀是CuI,棕色溶液含有I2
B.滴加KI溶液时,转移1mol电子时生成1mol白色沉淀
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:I2>Cu2+>SO2
查看答案和解析>>
科目:高中化学 来源:2016届江汉油田海南海政学校高三月考化学试卷(解析版) 题型:选择题
将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是
A.3 mol·L-1HCl B.4 mol·L-1HNO3
C.8 mol·L-1NaOH D.18 mol·L-1浓H2SO4
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三7月月考化学试卷(解析版) 题型:填空题
(14分)亚硫酸钠(Na2SO3)、漂白液(NaClO)和明矾[KAl(SO4)2?12H2O]都是重要的化工产品,在日常生活和工业生产中都有广泛用途,且三者都可用在造纸业的不同生产工序中。
(1)NaClO做消毒液是它能与水反应产生一种强氧化性物质,写出该强氧化性物质的电子式_______。在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:____________。将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式 ____________。
(2)将饱和NaClO和KAl(SO4)2溶液混合,置于一只带单孔橡皮塞的大试管中,产生大量的白色胶状沉淀。此时反应的离子方程为____________。再将大试管置于阳光下照射,不久试管液面上方有浅黄绿色气体产生,将气体通入NaOH溶液充分吸收后,还能收集到一种无色无味的气体。写出在阳光照射下,混合液中反应的化学方程式____________。
若将KAl(SO4)2溶液换成硫酸亚铁铵【(NH4)2SO4?FeSO4】溶液后,再与NaClO溶液混合,观察到大试管中有红褐色沉淀产生,同时溶液里现黄色,但没有气体生成。此时试管中发生反应的离子方程式为______。
(3)取一定体积KAl(SO4)2溶液于试管中,逐滴加入一定浓度的Ba(OH)2溶液, 直至产生沉淀的质量最大,写出此时的离子反应方程式____________。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期开学考试化学试卷(解析版) 题型:选择题
化学与生活、社会密切相关,下列说法正确的是
A.光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材料主要是SiO2
B.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作致冷剂
C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性
D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com