
| A. | 2:9 | B. | 10:9 | C. | 9:2 | D. | 9:10 |
分析 90℃时,水的离子积为10-12,则该温度下c(H+)=$\sqrt{{k}_{w}}$=$\sqrt{1{0}^{-12}}$mol/L=10-6 mol/L,其pH=6,混合溶液pH=11>6,所以混合溶液呈碱性,pH=12的NaOH溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-12}}$mol/L=1mol/L,pH=l的H2SO4溶液c(H+)=0.1mol/L,混合溶液pH=11,则混合溶液中c(OH-)=$\frac{1×{V}_{1}-0.1×{V}_{2}}{{V}_{1}+{V}_{2}}$mol/L=$\frac{1{0}^{-12}}{1{0}^{-11}}$mol/L,据此计算V1:V2.
解答 解:90℃时,水的离子积为10-12,则该温度下c(H+)=$\sqrt{{k}_{w}}$=$\sqrt{1{0}^{-12}}$mol/L=10-6 mol/L,其pH=6,混合溶液pH=11>6,所以混合溶液呈碱性,pH=12的NaOH溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-12}}$mol/L=1mol/L,pH=l的H2SO4溶液c(H+)=0.1mol/L,混合溶液pH=11,则混合溶液中c(OH-)=$\frac{1×{V}_{1}-0.1×{V}_{2}}{{V}_{1}+{V}_{2}}$mol/L=$\frac{1{0}^{-12}}{1{0}^{-11}}$mol/L,V1:V2=2:9,
故选A.
点评 本题考查酸碱混合溶液定性判断及pH有关计算,为高频考点,侧重考查学生分析计算能力,注意该温度下水的离子积常数不是常温下离子积常数,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
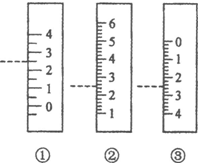 以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:
以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
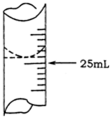 欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:| 实验序号 | 待测NaOH溶液的体积/mL | HCl标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.10 |
| 2 | 25.00 | 1.50 | 21.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该反应属于取代(填“取代”或“加成”)反应.
,该反应属于取代(填“取代”或“加成”)反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )
人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )| A. | A为电源的负极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将不变 | |
| C. | 阳极室中发生的电极反应为2H++2e-═H2↑ | |
| D. | 若两极共收集到气体13.44 L(标准状况),则除去的尿素为18g(忽略气体的溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
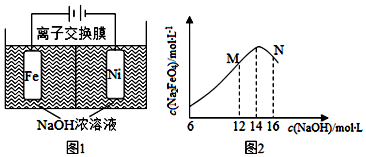
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 次数 | 盐酸体积 (mL) | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com